PCl5的热分解反应如下:PCl5(g)  PCl3(g) + Cl2(g)。
PCl3(g) + Cl2(g)。
(1)写出反应的平衡常数表达式;
(2)已知某温度下,在容积为10.0L的密闭容器中充入2.00mol PCl5,达到平衡后,测得容器内PCl3的浓度为0.150mol/L。求该温度下的平衡常数。
(3)在相同的容器中起始充入5.00mol PCl5,达平衡后, PCl5的分解率是多少?
(7分)将等物质的量A、B混合于2L的密闭容器中,发生如下反应:3A(g)+B(g) xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol/L,c(A):c(B)=3:5,
C的平均反应速率是0.1m0L/(L·min)
求:(1)反应开始前放入容器中A、B物质的量。
(2)B的平均反应速率。
(3)x值是多少?
将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:
3A(g)+B(g) xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L·min),且此时A、B的物质的量浓度之比为3∶5。求:
xC(g)+2D(g),经5min后,测得D的浓度为0.5mol·L-1,C的平均反应速率是0.1mol/(L·min),且此时A、B的物质的量浓度之比为3∶5。求:
(1)此时A的浓度及反应开始前放入容器中A、B的物质的量。
(2)B的平均反应速率。
(3)x的值是多少?
I.恒温、恒压下,在一个容积可变的容器中发生如下反应:
A(g)+B(g)  C(g)
C(g)
若开始时放入1molA和1molB,到达平衡后,生成a mol C,这时A的物质的量为_____mol。
若开始时放人3molA和3molB,到达平衡后,生成C的物质的量为 mol。
若开始时放人x mol A、2molB和l mol C,到达平衡后,A和C的物质
的量分别是y mol和3a mol,则x ="___________mol," y =___________mol。平衡时,B的物质的量________(选填一个编号)。
(甲)大于2mol (乙)等于2mol
(丙)小于2mol (丁)可能大于、等于或小于2mol。
(4)若在(3)的平衡混合物中再加入3molC,待再次到达平衡后,C的物质的量分数是____。
II.若维持温度不变,在一个与(1)反应前起始体积相同、且容积固定的容器中发生上述反应。
(5)开始时放人l mol A和l mol B到达平衡后生成b mol C。将b与(1)小题中的a进行比较________________ (选填一个编号)。
(甲)a < b (乙) a > b (丙) a = b (丁)不能比较a和b的大小。
恒温下,将amol N2和b mol H2的混合气体通入一固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)  2NH3(g),
2NH3(g),
(1)若反应进行到某时刻t时刻,n(N2)="13mol," n(NH3)=6mol,则a=?
(2)反应达到平衡时,混合气体的体积为716.8L(标况),其中NH3的含量为25%(体积分数),则平衡时n(NH3)=?
(3)原混合气体中,a:b=?
(4)平衡混合气体中,n(N2) :n(H2): n(NH3)=?
某化学反应2A(g) 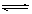 B(g) + D(g)在四种不同条件下进行,反应器均为相同恒容密闭容器,B、D起始浓度为0。反应物A的浓度(
B(g) + D(g)在四种不同条件下进行,反应器均为相同恒容密闭容器,B、D起始浓度为0。反应物A的浓度( )随反应时间(min)的变化情况如下表:
)随反应时间(min)的变化情况如下表:
| 实验 序号 |
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800℃ |
C2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
800℃ |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)在实验1中,反应在10~20分钟内用A表示的平均速率为 ____________ 。
(2)在实验2中,A的初始浓度C2=  ,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为υ3,实验1的反应速率为υ1,则υ3 υ1(填>、=、<),且C3=  。
。
(4)由上述实验,可推测该反应是 反应(选填“吸热”或“放热”)。理由是:
。
(5)1~4组实验中,A的平衡转化率最大的是第 组。
(6)在实验2中,50 min后,若将容器体积增大1倍,则达平衡时B的浓度为 _____  ;该反应的平衡常数K (填“不变”或“增大”或“减小”)。
;该反应的平衡常数K (填“不变”或“增大”或“减小”)。
分别为0.6mol和0.5mol的A、B两种气体,充入0.4L密闭容器中发生反应:3A(g)+B(g)  mC(g)+2D(g),经5min达到平衡,此时C为0.2mol。又知在此反应时间内D的平均反应速率为0.1mol·L-1·min-1,回答下列问题:
mC(g)+2D(g),经5min达到平衡,此时C为0.2mol。又知在此反应时间内D的平均反应速率为0.1mol·L-1·min-1,回答下列问题:
(1)m值为 ;
(2)B的转化率为 ;
(3)平衡时容器内物质的总物质的量为 ;
(本题共8分)
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示_________________,
K值大小与温度的关系是:温度升高,K值______________
(填一定增大、一定减小、或可能增大也可能减小)。
(2)在一体积为10L的容器中,通人一定量的CO和H2O,在850℃时发生如下反应:
CO(g)十H2O(g)  CO2(g)十H2 (g)十Q(Q>0)
CO2(g)十H2 (g)十Q(Q>0)
CO和H2O浓度变化如下图,则 0—4min的平均反应速率v(CO)=______ mol/(L·min)
(3)t℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3min—4min之间反应处于_________状态; C1数值_________0.08 mol/L (填大于、小于或等于)。
②反应在4min—5min问,平衡向逆方向移动,可能的原因是________(单选),表中5min—6min之间数值发生变化,可能的原因是__________(单选)。
a.增加水蒸气 b.降低温度
c.使用催化剂 d.增加氢气浓度
往容积为10L的密闭容器内通入40molN2和120molH2,在一定条件下进行反应,经2s后达到平衡状态,平衡时c(N2)为2mol/L。
(1)用H2的浓度变化表示2s内的平均速率为 。
(2) 氮气的转化率是 。
(3) 平衡时混合气体中氨的体积分数是 。
(4) 容器内反应前后压强比是 。
将CH4与H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
(1)某温度下将等物质的量的CH4和H2O(g)充入密闭容器中,使容器体积为2L,控制容器体积不变,3min时反应达到平衡,平衡常数K=27,此时测得CO的物质的量为0.20mol,求①3min内H2的生成速率②CH4的平衡转化率(计算结果保留两位有效数字)。(需有计算过程)
(2)若和(1)相同的初始条件,但在恒压条件下进行该反应,则达平衡时,CH4的转化率与(1)的比较,是( )
| A.增大 | B.减小 | C.相等 | D.无法确定 |
( 12分)一定温度下,将3 molA气体和1 molB气体通入一密闭容器中,发生如下反应:3A(g)+B(g)  xC(g),请填写下列空白:
xC(g),请填写下列空白:
(1)若容器体积固定为 2 L,反应1 min 时测得剩余1.8 mol A,C的浓度为0.4 mol/L。
①1 min内,B的平均反应速率为________;x为________。
②若反应经2 min达到平衡,平衡时C的浓度________0.8 mol/L(填“>、<、=”)
③平衡混合物中,C的物质的量占气体总物质的量的3/7,则A的转化率是________。
④改变起始物质加入的量,欲使反应达到平衡时C的物质的量分数与原平衡相等,起始加入的三种物质的物质的量n(A)、n(B)、n(C)之间应满足的关系式____ __________ __ _______。
(2)若维持容器压强不变,达到平衡时C的体积分数________(1)中平衡时C 的体积分数(填“>、<、=”);
(10分) (1)已知某反应的各物质浓度数据如下:
_ 


起始浓度( ): 1.5 1.0 0
): 1.5 1.0 0
2s末浓度( ): 0.9 0.8 0.4
): 0.9 0.8 0.4
则①a= ,b= 。
②2s内B的转化率= 。
(2)由碳棒,铁片和200mL 1.5mol/L的稀硫酸组成的原电池中,当在碳棒上产生气体3.36L(标准状况)时,求
③有 mol电子从 通过电线到 (填“铁片”或“碳棒”)。
④此时溶液中H+的物质的量浓度为 (不考虑溶液体积变化)。
(3)将2.3g金属钠放入足量的m g重水(D2O)中,完全反应后,所得溶液中溶质的质量分数是 (用含m的代数式表示。)
在某温度下,将 和
和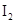 各0.1mol的气态混合物充入10L的密闭容器中,充分反应,连续测定
各0.1mol的气态混合物充入10L的密闭容器中,充分反应,连续测定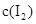 的变化,5S时测定
的变化,5S时测定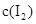 =0.0080mol/L并保持不变。H2+I2(g)
=0.0080mol/L并保持不变。H2+I2(g)  2HI(g)
2HI(g)
(1)反应的平衡常数的表达式是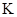 = ;
= ;
(2)此温度下,平衡常数值为 ;
(3)若在此温度下,在10L的密闭器充入0.2molHI气体,达到平衡时,HI的转化率为 。
在带有活塞的密闭容器中压入5molH2和5molN2,在某温度下经反应生成2molNH3,若此时容器的压强不变,则容器体积是反应前的多少倍?