[河南]2011-2012学年河南省郑州市高二上学期期末调研测试化学试卷
已知Zn(s)+H2SO4(aq)===ZnSO4(aq)+H2(g) ΔH <0;则下列关于该反应的叙述不正确的是
| A.反应物的总能量高于生成物的总能量 |
| B.上述热化学方程式中的ΔH的值与反应物的用量无关 |
| C.该反应的化学能可以转化为电能 |
| D.该反应中旧键断裂吸收能量,新键形成放出能量,所以物质的总能量不变 |
下列对化学反应方向的叙述,正确的是
| A.室温下不能自发进行的反应,在高温下有可能自发进行 |
| B.熵增加有利于反应的自发进行,熵减少的反应常温下都不会自发进行 |
| C.非自发反应在任何情况下都不会发生 |
| D.ΔH-TΔS作为化学反应方向的判据,在任何条件下都适用 |
据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是 B
高温下,某反应达到平衡,平衡常数数K=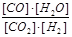 。已知恒容时升高温度,
。已知恒容时升高温度,
H2的浓度减小。下列说法正确的是
A.该反应的化学方程式为CO+H2O CO2+H2 CO2+H2 |
| B.该反应的△H>0 |
| C.升高温度,正反应速率增大,逆反应速率减小 |
| D.恒温恒容下,增大压强,H2的浓度一定减小 |
金属腐蚀造成的损失非常严重,金属腐蚀可分为化学腐蚀和电化学腐蚀。下列现象不能用电化学腐蚀来解释的是
| A.铜板上的铁铆钉在阴雨天易生锈 |
| B.马口铁(镀锡的铁)破损后很快生锈 |
| C.铜器皿在高温环境中迅速变黑 |
| D.电工作业中若将铜、铝导线直接相连易出现接触不良现象 |
下图是某同学做完Zn—Cu原电池实验后所做的读书卡片记录,其中描述合理的组合是
| A.①②③ | B.②③④ | C.④⑤⑥ | D.③④⑤ |
常温下,物质的量浓度均为0.1mol·L-1的下列溶液:①CH3COONa ②NaOH ③NaHSO4
④NH4Cl ⑤ NaCl,溶液的pH由大到小的顺序排列正确的是
| A.②>⑤>①>③>④ | B.②>①>⑤>③>④ |
| C.②>①>⑤>④>③ | D.②>⑤>③>④>① |
室温下向10mL pH=3的醋酸溶液中加水稀释后,下列说法正确的是
| A.溶液中导电粒子的数目减小 |
B.溶液中的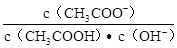 不变 不变 |
| C.醋酸的电离程度增大,c(H+)亦增大 |
| D.再加入10mL pH=11的NaOH溶液,混合液pH=7 |
在甲、乙两烧杯溶液中,共含有大量的Cu2+、K+、H+、NO、CO、OH-。已知甲烧杯的溶液呈蓝色,则乙烧杯中大量存在的离子是
| A.Cu2+、H+、NO | B.K+、H+、NO |
| C.CO、OH-、NO | D.K+、CO、OH- |
下列表示对应化学反应的离子方程式正确的是
| A.FeBr2溶液中通入少量Cl2:2Fe2+ + Cl2= 2Fe3++ 2Cl- |
| B.FeCl3溶液与Cu反应:Cu+Fe3+= Cu2++Fe2+ |
| C.醋酸溶解水垢中的CaCO3:CaCO3+2H+= Ca2++H2O+CO2↑ |
| D.向Na[Al(OH)4]溶液中通入过量CO2:2[Al(OH)4]- +CO2= 2A(OH)3↓ + CO32-+H2O |
右图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。 下列说法一定正确的是
下列说法一定正确的是
| A.该反应为吸热反应 |
| B.反应物吸收的总能量小于生成物释放的总能量 |
| C.a与b相比,反应的平衡常数一定不同 |
| D.a与b相比,a的反应速率更快 |
在一定条件下,向0.1 mol/L的CH3COONa溶液中滴加CH3COOH溶液至混合溶液中离子浓度满足如下关系c(Na+) + c(OH-) = c(H+)+ c(CH3COO-),则下列叙述正确的是
| A.混合溶液中:c(OH-) >c(H+) |
| B.混合溶液中:c(CH3COO-)=" 0.1" mol/L |
| C.混合溶液中:c(Na+) > c(CH3COO-) |
| D.混合溶液中:c(Na+) = c(CH3COO-) |
已知:Ksp(RCl)=1.8×10—10,Ksp(RI)=1.5×10—16 ,Ksp(R2CrO4)=2.0×10—12,则下列难溶盐的饱和溶液中,R+浓度大小顺序正确的是
| A.RCl>RI> R2CrO4 | B.RCl> R2CrO4>RI |
| C.R2CrO4>RCl>RI | D.R2CrO4>RI>RCl |
一种新型酸性乙醇电池用磺酸类质子作溶剂,比甲醇电池效率高出32倍,电池反应式为C2H5OH + 3O2 =" 2" CO2 + 3H2O,电池构造如下图。下列关于该电池的说法不正确的是
| A.放电过程中,电源内部的H+从正极区向负极区迁移 |
| B.通入乙醇的电极是负极 |
C.该电池的正极反应为:4H+ + O2 + 4 = 2H2O = 2H2O |
| D.用该电池做为电源,用惰性电极电解饱和NaCl的水溶液时,每消耗0.2 mol C2H5OH,阳极产生标准状况下气体的体积为26.88 L |
已知在298K、101kPa时,
(1)
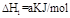 (2)
(2)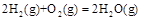

(3)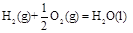
 (4)
(4)

下列关系式中正确的是
| A.2a=b<0 | B.a<c<0 | C.b>d>0 | D.2c=d>0 |
某温度下,反应H2(g)+CO2(g) H2O(g)+CO(g)的平衡常数
H2O(g)+CO(g)的平衡常数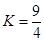 。该温度下在体积均为10 L的三个密闭容器中分别加入反应物,起始加入量如下图所示:
。该温度下在体积均为10 L的三个密闭容器中分别加入反应物,起始加入量如下图所示:
| 起始量 |
甲 |
乙 |
丙 |
| H2 (mol) |
1 |
2 |
2 |
| CO2(mol) |
1 |
1 |
2 |
下列判断不正确的是
A.反应开始时,甲中的反应速率最慢,丙中的反应速率最快
B.平衡时,甲和丙中CO2的转化率相等,均是60%
C. 平衡时, 乙中H2的转化率大于60%
D. 平衡时, 丙中c(H2 ) 是0. 08 mol·L-1
漂白粉是日常生活中的一种常用消毒剂、杀菌剂和漂白剂。请根据要求回答问题:
(1)漂白粉的有效成分是次氯酸钙[Ca(ClO)2],将氯气通入熟石灰(含水的质量分数略小于1%)即可制取,该反应的化学方程式为 ______________________________。
(2)漂白粉具有漂白作用是因为Ca(ClO)2水解生成了次氯酸(HClO),写出该水解反应的离子方程式_______________________________。
(3)Ca(ClO)2溶液中各离子浓度由大到小的顺序是____________________________。
(4)空气中的二氧化碳可以可增强漂白粉的漂白效果,用化学方程式表示其原理__________________________________________。
(5)漂白粉与洁厕剂等强酸性物质混合使用可生成一种有毒气体,写出该反应的离子方程式________________________________________。
某种工业废水中含有一定量的Cr2O72-和CrO42-,它们易被人体吸收积累而导致肝癌。污水处理厂常用还原沉淀法处理含铬废水,其流程如下: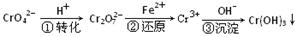
(1)已知第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
①Cr2O72-中Cr的化合价是 。
②若平衡体系的pH=10,则溶液显 色。
(2)第②步发生反应的离子方程式为 _______ ,还原1mol Cr2O72—离子,需要_______mol的FeSO4·7H2O;
(3)常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
氯碱工业中电解饱和食盐水的原理示意图如下图所示: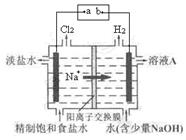
(1)电极a是电源的 。
(2)溶液A的溶质是(填化学式) 。
(3)电解饱和食盐水的离子方程式是 。
(4)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用 _______________________________________________________ 。
(5)电解所用的盐水需精制,去除盐水中的Ca2+、Mg2+、NH4+和SO42-,提供的试剂有① Na2CO3溶液② BaCl2 溶液③ NaOH溶液④ HCl,加入试剂的顺序是________________。
利用所学化学反应原理,解决以下问题:
(1)某溶液含两种相同物质的量的溶质,溶液中只存在OH—、H+、NH4+、Cl-四种离子,且c(NH4+)>c(Cl-)>c(OH—)>c(H+),则这两种溶质是 _________ 。
(2)0.1 mol·L-1的氨水与0.05 mol·L-1的稀硫酸等体积混合,用离子方程式表示混合后溶液的酸碱性: 。
(3)以石墨电极电解100 mL 0.1 mol·L-1CuSO4溶液。若阳极上产生气体的物质的量为0.01 mol,则阴极上析出Cu的质量为 g。
(4)将AgCl分别放入①5mL H2O ②10mL0.2mol·L-1 MgCl2③20 mL0.5mol·L-1 NaCl溶液④40 mL0.1mol·L-1HCl中溶解至饱和,各溶液中Ag+的浓度由大到小的顺序是________________。
(5)向20 mL硫酸和盐酸的混合液中逐滴加入pH=13的Ba(OH)2溶液,生成BaSO4的量如右图所示,B点溶液的pH=7(忽略溶液体积变化),则c(HCl)=_________mol·L-1。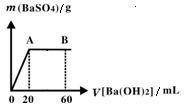
氮是一种地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。
(1)下图是1 mol NO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式 。
(2)已知:N2(g)+ O2(g)=" 2" NO(g) △H = +180 kJ • mol-1
2NO(g)+2 CO(g)= N2(g) + 2 CO2(g) △H =" -" 746 kJ • mol-1
则反应CO(g) +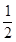 O2(g)= CO2(g)的△H = kJ • mol-1
O2(g)= CO2(g)的△H = kJ • mol-1
(3)在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应: N2(g)+3H2(g) 2NH3(g) △H <0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 ,该反应的平衡常数表达式K = 。
2NH3(g) △H <0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2 mol,平衡时H2的转化率为 ,该反应的平衡常数表达式K = 。
(4) 在固定体积的密闭容器中,1.0×103 kPa时反应 N2(g)+3H2(g) 2NH3(g)
2NH3(g)
△H<0 的平衡常数K与温度T的关系如下表:
| T/K |
298 |
398 |
498 |
| 平衡常数K |
51 |
K1 |
K2 |
①K1 K2(填写“>”、“=”或“<”)
②下列各项能说明上述合成氨反应一定达到平衡状态的是 (填字母)
a.容器内N2、H2、NH3的浓度之比为1:3:2 b.NH3的浓度保持不变
c.容器内压强保持不变 d.混合气体的密度保持不变
某化学反应2A(g) 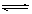 B(g) + D(g)在四种不同条件下进行,反应器均为相同恒容密闭容器,B、D起始浓度为0。反应物A的浓度(
B(g) + D(g)在四种不同条件下进行,反应器均为相同恒容密闭容器,B、D起始浓度为0。反应物A的浓度( )随反应时间(min)的变化情况如下表:
)随反应时间(min)的变化情况如下表:
| 实验 序号 |
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 1 |
800℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
800℃ |
C2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
800℃ |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
820℃ |
1.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)在实验1中,反应在10~20分钟内用A表示的平均速率为 ____________ 。
(2)在实验2中,A的初始浓度C2=  ,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为υ3,实验1的反应速率为υ1,则υ3 υ1(填>、=、<),且C3=  。
。
(4)由上述实验,可推测该反应是 反应(选填“吸热”或“放热”)。理由是:
。
(5)1~4组实验中,A的平衡转化率最大的是第 组。
(6)在实验2中,50 min后,若将容器体积增大1倍,则达平衡时B的浓度为 _____  ;该反应的平衡常数K (填“不变”或“增大”或“减小”)。
;该反应的平衡常数K (填“不变”或“增大”或“减小”)。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号