某化学兴趣小组在加热条件下利用二氧化锰和浓盐酸反应来制取并收集氯气。
(1)若要制取纯净干燥的氯气,应使气体依次通过装有____________和__________的洗气瓶。
(2)某同学不慎将MnO2和KCl粉末混合了,分离该混合物的方法和步骤如下,请补充完整,①先在盛有混合粉末的烧杯中加入适量的水溶解;②将①所得的混合物过滤,该操作所用玻璃仪器有_________、玻璃棒、烧杯;③洗涤、干燥沉淀得到MnO2;将第②步操作所得液体_______________(填操作名称)得到KCl固体。
在如下图装置中,用NaOH溶液、铁屑、稀硫酸等试剂制备Fe(OH)2。
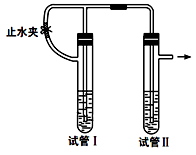
(1)在试管I中加入的试剂是 。
(2)为了制得Fe(OH)2白色沉淀,在试管I和Ⅱ中加入试剂,打开止水夹,塞紧塞子后观察到试管I产生大量气体。一段时间后,检验到试管Ⅱ支管出口的气体只有一种时,再进行的操作是 ,使试管I中的溶液进入到试管Ⅱ中溶液底部,产生Fe(OH)2。
(3)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是 。
(4)反应结束后,将Fe(OH)2沉淀倒出,在空气中迅速变为灰绿色,最后变为红褐色,其原因是 (用化学方程式表示)。
草酸亚铁为黄色固体,作为一种化工原料, 可广泛用于涂料、染料、陶瓷、玻璃器皿等的着色剂以及新型电池材料、感光材料的生产。合成草酸亚铁的流程如下:

(1)配制(NH4)2Fe(SO4)2溶液时,需加入少量稀硫酸,目的是 。
(2)得到的草酸亚铁沉淀需充分洗涤,检验是否洗涤干净的方法是 。
(3)将制得的产品(FeC2O4·2H2O)在氩气气氛中进行加热分解,结果如下图(TG%表示残留固体质量占原样品总质量的百分数)。
①则A→B发生反应的化学方程式为: 。

②已知B→C过程中有等物质的量的两种气态氧化物生成,写出B→C的化学方程式 ;
(4)某草酸亚铁样品中含有少量草酸铵。为了测定不纯产品中草酸根的含量,某同学做了如下分析实验:
Ⅰ.准确称量m g样品,溶于少量2mol/L硫酸中并用100mL容量瓶定容。
Ⅱ.取上述溶液20mL,用c mol/L高锰酸钾标准溶液滴定,溶液变为淡紫色,消耗高锰酸钾溶液的体积为V1 mL。
Ⅲ.向上述溶液中加入足量Zn粉,使溶液中的Fe3+恰好全部还原为Fe2+。
Ⅳ.过滤,洗涤剩余的锌粉和锥形瓶,洗涤液并入滤液
Ⅴ.用c mol/L KMnO4溶液滴定该滤液至溶液出现淡紫色,消耗KMnO4溶液的体积V2 mL。
已知:2MnO4-+5H2C2O4+6H+=2Mn2+ +10CO2+8H2O
MnO4-+8H++5Fe2+=5Fe3+ + Mn2++4H2O
回答下列问题:
①若省略步骤Ⅳ,则测定的草酸根离子含量 (填“偏大”、“偏小”或“不变”)。
②m g样品中草酸根离子的物质的量为 (用c,V1,V2的式子表示,不必化简)。
实验室用MnO2粉末与浓盐酸共热制取氯气:
MnO2+4HCl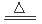 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
实验Ι 验证氯气能否与水反应
某同学设计了如下图所示的实验装置:
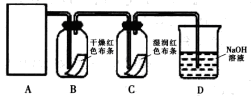
(1)从下图选择适合A处的装置__________(填序号)。
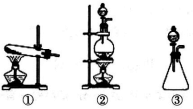
(2)装置B中能否观察到预期的实验现象?_________(填“能”或“不能”),请说明理由______________。
实验II 测定反应后A中残余盐酸的浓度
步骤一:配制100mL1.00mol∙L-1的NaOH溶液,配制过程如下:
①称量_______gNaOH固体,在烧杯中用适量蒸馏水溶解,冷却。
②将烧杯中的溶液转移至________中,并用少量蒸馏水洗涤烧杯内壁及玻璃棒2~3次,洗涤液也注入容量瓶中。
③继续加蒸馏水至离刻度线1~2cm处,改用_________滴加蒸馏水至凹槽面最低处与刻度线相切。
④盖上瓶塞,上下颠倒摇匀,将所配溶液转移至指定试剂瓶中,贴上标签。
步骤二:取2.00mL反应后A中的溶液,稀释后滴加步骤一配制所得NaOH溶液,恰好完全反应时,消耗NaOH溶液的体积为11.80mL。
(3)完成步骤一的空格。
(4)根据实验数据,计算反应后A中残余盐酸的浓度为_________mol∙L-1。
(5)某同学欲通过测Cl-浓度来推测反应后A中残余盐酸的浓度,取2.00mL反应后A中的溶液,加入2.00mol∙L-1AgNO3溶液至不再产生沉淀时,发现所加的AgNO3溶液的体积远大于理论值5.80mL,其原因是____________。
苯甲酸(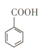 )和乙醇在浓硫酸催化下可以制得苯甲酸乙酯,及时除去反应中产生的水可提高酯的产率。据此某实验小组设计了如下图的装置来进行上述实验。相关信息如下:
)和乙醇在浓硫酸催化下可以制得苯甲酸乙酯,及时除去反应中产生的水可提高酯的产率。据此某实验小组设计了如下图的装置来进行上述实验。相关信息如下:
| |
相对分子质量 |
密度/(g·cm-3) |
沸点/℃ |
水中溶解度 |
| 苯甲酸 |
122 |
1.27 |
249 |
微溶 |
| 乙醇 |
46 |
0.789 |
78.3 |
易溶 |
| 苯甲酸乙酯 |
150 |
1.05 |
212.6 |
难溶 |
实验方案为:
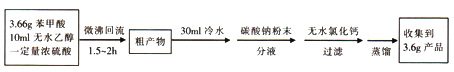

(1)仪器甲的名称为________________。
(2)①往丙中加入药品的顺序为_________________。
A.无水乙醇、浓硫酸、苯甲酸晶体 B.浓硫酸、苯甲酸晶体、无水乙醇
C.苯甲酸晶体、无水乙醇、浓硫酸 D.苯甲酸晶体、浓硫酸、无水乙醇
②若加热反应后发现未加沸石,应采取的正确操作是_____________。
③微沸回流过程中,可以看到乙内的混合试剂的颜色变为_______色。
(3)加入碳酸钠粉末的作用是__________________。
(4)分液要用到的玻璃仪器有__________,粗产物在_______层(填“上”或“下”)。
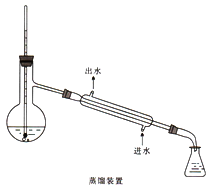
(5)加热蒸馏若采用下图装置(加热装置已经略去)进行,该装置存在的2个问题为__________、________。
(6)本实验所得到的苯甲酸乙酯产率为______________。
(7)装置乙的作用为____________________
1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用图9所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。请填写下列空白:
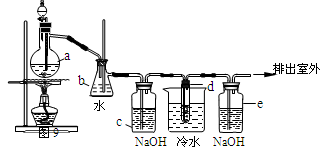
(1)烧瓶a要求温度迅速升高到170℃发生反应,写出该反应的化学方程式 ;该反应类型为 。
(2)写出制备1,2-二溴乙烷的化学方程式 。
(3)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞。请写出发生堵塞时瓶b中的现象 。
(4)容器c中NaOH溶液的作用是 ;e装置内NaOH溶液的作用是 。
(5)某学生做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量,比正常情况下超出许多,如果装置的气密性没有问题,试分析其可能的原因(至少2点) 、 。
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”,并收集纯净干燥的气体。请回答该实验中的问题。
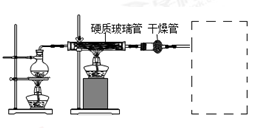
(1)写出该反应的化学方程式 ;干燥剂是_________(写名称)。
(2)圆底烧瓶中盛装的水,该装置受热后的主要作用是 ;烧瓶底部放置了几片碎瓷片,其作用是 。
(3)试管中收集气体是 (写化学式),如果要在A处玻璃管处点燃该气体,则必须对该气体进行 。在虚线框内画出收集该气体的装置图。(限选仪器:试管、玻璃导管、水槽)
(4)反应后得到黑色固体,主要成分是Fe3O4,还含有少量Fe和FeO;限选以下试剂:稀HNO3、稀HCl、KSCN溶液、氯水、CuSO4溶液;
设计实验方案检验所得固体中含有Fe3O4,写出实验步骤和实验现象_____________。
‚证明固体中含有没完全反应的Fe____________________________。
根据题目要求填空:
(1)硫、氮的氧化物是主要的大气污染物,对大气的影响之一是导致酸雨。用化学方程式表示NO2形成酸雨的原因: ,该反应中氧化剂和还原剂的物质的量之比为 。
(2)实验室常用的几种气体发生装置如图A、B、C所示:
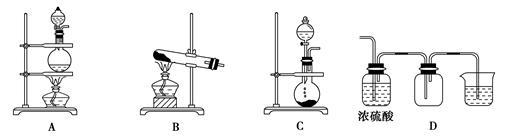
实验室可以用B或C装置制取氨气,如果用B装置,反应的化学方程式是______________;如果用C装置,通常使用的药品是______________(写名称);
‚下图是某学生设计收集氨气的几种装置,其中可行的是______________。
ƒ若用A装置与D装置相连制取并收集X气体,则X可能 是下列气体中的_____________
A.CO2 B.NO C.Cl2 D.H2
写出A装置中反应的离子方程式_______________。
(3)氢化钠(NaH)是一种还原性极强的物质,广泛应用于工业生产。
氢化钠(NaH)中Na元素的化合价为+1,在高温下氢化钠(NaH)可将四氯化钛(TiCl4)还原成金属钛,该反应的化学方程式为 。
‚NaH能与水剧烈反应:NaH+H2O===NaOH+H2↑,NaH与液氨(NH3)也有类似反应,该反应的化学方程式为_________________________。
如果有12g NaH参加此反应,则转移电子的物质的量为________mol
(4)用SiHCl3与过量H2反应制备纯硅的装置如图所示(热源及夹持装置均已略去):
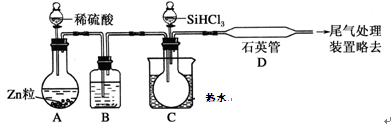
SiHCl3遇水剧烈反应生成H2SiO3、HCl和另一种物质,写出配平的化学反应方程式:_____________;H2还原SiHCl3过程中若混入O2,可能引起的后果是___________;
实验室用下列仪器和药品制取并收集干燥纯净的氯气。
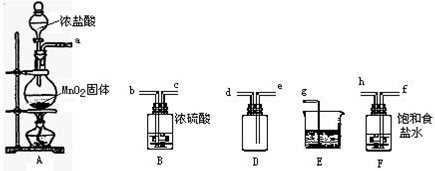
(1) 盛有浓盐酸的仪器名称是___________________。
(2)按气流从左到右,装置正确的连接是:a 接( )、( )接( )、( )接( )、( )接( )(填各接口字母)
(3)装置F 的作用是__________,装置B 的作用是____________。
(4)装置E 中发生反应的化学方程式是____________________。
(5)装置A 中发生反应的化学方程式是_________________________,
若A 中有4.48L 氯气产生(标准状态下),则参加反应的HCl有_______________g。
实验室用溴和苯在FeBr3催化下制取溴苯,得到粗溴苯后,要用如下操作提纯:(1)蒸馏;(2)水洗;(3)用干燥剂干燥;(4)用10%的NaOH溶液洗涤。正确的操作顺序是
| A.(1)(2)(3)(4) | B.(4)(2)(3)(1) |
| C.(4)(1)(2)(3) | D.(2)(4)(2)(3)(1) |
从海带中提取碘,可经过以下实验步骤完成。下列有关说法正确的是
| A.在灼烧过程中使用的仪器只有酒精灯、三脚架、泥三角、烧杯、玻璃棒 |
| B.在上述氧化过程中发生反应的离子方程式为2I-+H2O2=I2+2OH— |
| C.在提取碘单质时,用酒精作萃取剂 |
| D.在分液时,待下层液体完全流出后,关闭旋塞,上层液体从上口倒出 |
仅用下表提供的实验器材和药品,就能达到相应实验目的的是
| 编号 |
实验器材 |
实验药品 |
实验目的 |
| A |
托盘天平(带砝码)、100mL容量瓶、量筒、烧杯、药匙、玻玻棒 |
NaCl固体、蒸馏水 |
配制100 mL一定物质的量浓度的NaCl溶液 |
| B |
大试管、长颈漏斗、有孔塑料板、导管及橡皮塞、集气瓶、玻璃片、火柴 |
稀盐酸、块状石灰石 |
制取并收集二氧化碳气体 |
| C |
碱式滴定管、酸式滴定管、胶头滴管、铁架台(带铁夹)、锥形瓶 |
己知浓度的NaOH溶液、待测盐酸、蒸馏水、白纸 |
测定稀盐酸的物质的量浓度 |
| D |
铁架台(带铁夹)、酒精灯、大试管、集气瓶、导管及橡皮塞 |
氯化铵 |
制取并收集氨气 |
27. 如图所示是中学化学实验中常见的装置,它有多种用途。
⑴若瓶中装有X溶液,将CO和CO2的混合气体由a管口通入,用以除去CO2,则X为________。
| A.H2SO4 | B.NaOH | C.NaCl | D.HCl |
⑵若用排水法收集H2,则H2气体应从_______(填标号,下同)管口导入;若用排空气法收集CO2,则CO2气体应从________ 管口导入。
⑶医院里给病人输氧时,往往在氧气钢瓶与病人呼吸面具之间安装有水的该装置,观察气泡产生的情况,以便调节供氧速率,此时氧气应从 管口导入。
(每空1分,共7分)溴乙烷是一种重要的有机化工原料,其沸点为38.4℃。制备溴乙烷的一种方法是乙醇与氢溴酸反应,该反应的化学方程式是 。
实际通常是用溴化钠与一定浓度的硫酸和乙醇反应。某课外小组欲在实验室制备溴乙烷的装置如图,实验操怍步骤如下: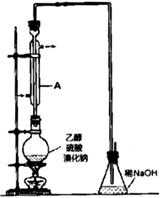
①检查装置的气密性;
②在圆底烧瓶中加入95%乙醇、80%硫酸,然后加入研细的溴化钠粉末和几粒碎瓷片;
③小心加热,使其充分反应。
请问答下列问题。
(1)装置A的作用是 。
(2)反应时若温度过高,则有 生成,同时观察到还有一种红棕色气体产生,该气体物质的电子式是 。
生成,同时观察到还有一种红棕色气体产生,该气体物质的电子式是 。
(3)反应结束后,得到的粗产品呈棕黄色。为了除去粗产品中的杂质,可选择下列试剂中的 (填写上正确选项的字母)。
a.饱和食盐水 b.稀氢氧化钠溶液 c.乙醇 d.四氯化碳
该实验操作中所需的主要玻璃仪器是 (填仪器名称)。
(4)要进一步制得纯净的溴乙烷,可继续用蒸馏水洗涤,分液后,再加入无水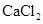 ,然后进行的实验操作是 (填写正确选项的字母)。
,然后进行的实验操作是 (填写正确选项的字母)。
a.分液 b.蒸馏 c.萃取
(5)为了检验溴乙烷中含有溴元素,通常采用的方法是取少量溴乙烷,然后 (按实验的操作顺序选填下列序号)。
①加热 ②加入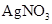 溶液 ③加入稀
溶液 ③加入稀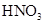 酸化 ④加入NaOH溶液
酸化 ④加入NaOH溶液
下图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略)。
⑴制备氯气选用的药品为:漂粉精固体和浓盐酸,相关的化学反应方程式为:
__________________________________________________________________。
⑵装置B中饱和食盐水的作用是_______________;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象______________________________。
⑶装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入_______。
| |
a |
b |
c |
d |
| I |
干燥的有色布条 |
干燥的有色布条 |
湿润的有色布条 |
湿润的有色布条 |
| II |
碱石灰 |
硅胶 |
浓硫酸 |
无水氯化钙 |
| III |
湿润的有色布条 |
湿润的有色布条 |
干燥的有色布条 |
干燥的有色布条 |
⑷设计装置D、E的目的是比较氯、溴、碘的非金属性。当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为______色,说明氯的非金属性大于溴。
⑸打开活塞,将装置D中少量溶液加入装置E中,振荡。观察到的现象是_____________。
⑹有人提出,装置F中可改用足量的NaHSO3溶液吸收余氯,试写出相应的离子反应方程式:
______________________,判断改用NaHSO3溶液是否可行______(填“是”或“否”)。