实验室用乙醇和浓H2SO4反应制取乙烯时,常发现反应混合液变黑,同时制得的乙醇具有刺激性气味,它是浓H2SO4氧化了乙醇的缘故。试求:
现有以下盛放于洗气瓶中的药品:
| A.溴水 | B.浓NaOH溶液 | C.澄清石灰水 |
| D.酸性KMnO4 E.品红溶液,请设计实验方案证明所制得的乙烯中混有CO2、SO2,同时乙烯能与溴水反应。 |
①写出气体通过洗气瓶时试剂放置的先后顺序(可重复选用) 。
②证明存在SO2的实验现象是 ;
③证明存在CO2的实验现象是 ,
④证明C2H4与溴水反应的实验现象是 。
海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图: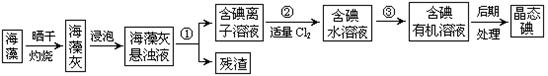
(1)指出提取碘的过程中有关的实验操作名称:① ,③ ;
过程②中有关反应的离子方程式为 。
(2)提取碘的过程中,可供选择的有机试剂是
| A.甲苯、酒精 | B.四氯化碳、苯 | C.汽油、乙酸 | D.汽油、甘油 |
(3)从含碘的有机溶液中提取碘和回收有机溶剂,还须经过蒸馏,指出右面实验装置图中的错误之处: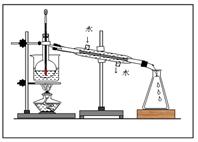
① ;
② ;
③ 。
(4)进行上述蒸馏操作时,使用水浴加热的原因是 ,最后晶态碘在 里聚集。
图为实验室制乙酸乙酯的装置。









 (1)在大试管中配制一定比例的乙醇、乙酸和浓H2SO4混合液的方法为:
(1)在大试管中配制一定比例的乙醇、乙酸和浓H2SO4混合液的方法为:
 (2)装置中通蒸汽的导管要插在饱和Na2CO3溶液的液面以上,不能插在溶液
(2)装置中通蒸汽的导管要插在饱和Na2CO3溶液的液面以上,不能插在溶液 中,目的是:
中,目的是:  (3)浓H2SO4的作用:
(3)浓H2SO4的作用:  (4)饱和Na2CO3的作用:
(4)饱和Na2CO3的作用:  (5)试管中加入沸石的作用:
(5)试管中加入沸石的作用:  (6)实验室生成的乙酸乙酯其密度比水 (填“大”或“小”),
(6)实验室生成的乙酸乙酯其密度比水 (填“大”或“小”), 有 的气味。
有 的气味。
实验室配制500ml 0.1mol·L-1的Na2CO3溶液,回答下列问题:
(1)应用托盘天平称取碳酸钠粉末 g。
(2)配制时应选用的仪器有500ml容量瓶,托盘天平、烧杯、药匙、 。
(3)若实验时遇到下列情况,所配溶液的浓度偏大的是 。
| A.加水定容时超过刻度线,又吸出少量水至刻度线; | B.忘记将洗涤液转入容量瓶; |
| C.容量瓶洗涤后内壁有水珠而未作干燥处理; | |
| D.称量碳酸钠粉末时左盘放砝码,右盘放药品; |
E、定容时俯视刻度线。
(8分)用98%的浓硫酸(其密度为1.84g/cm3)配制100mL1.0mol·L-1稀硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶
E.10mL量筒 F.胶头滴管 G.50mL烧杯 H.100mL容量瓶
(1)需量取浓硫酸的体积为 mL。
(2)实验时选用的仪器有(填序号)
(3)配制过程中,下列情况会使配制结果偏高的是(填序号)
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.将准确量取的18.4mol·L-1的硫酸,注入已盛有3 0mL水的100mL的容量瓶中,加水至刻度线
0mL水的100mL的容量瓶中,加水至刻度线
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
某学生活动小组设计了溴苯的制取装置,如图所示。请填写下列空白:
(1)制取溴苯的反应方程式是:
。
(2)在滴入混合液几分钟后,能观察到的现象是:
Ⅰ处: ,
Ⅱ处: ,
Ⅲ处: ,
Ⅳ处: 。
(3)在2~3min后,可以在a管底部得到 。
(4)NaOH的作用是 ,
U形管中苯的作用是 ,
AgNO3 溶液的作用是 。
实验室用下图所示装置通过制取NH3再和CuO 反应制得N2,同时还原CuO 得Cu 。
(1)写出(A)中反应的化学方程式_______ __;
(2)写出(C)中反应的化学方程式______,在此反应中NH3表现出_____性
(3)(B)中装有______ ___药品,作用是_____ ____。
(4)停止反应时,应先撤离_______ __装置中的酒精灯。
(5)从(C)装置出来的气体中可能含有_________气体,若要获得较纯的N2,应采用 _________方法收集。
如图在试管A中先加入2mL的甲,并在摇动下缓缓加入2mL乙,充分摇匀,冷却后再加入丙,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管B中加入5ml丁溶液,按图连接好装置,用酒精灯对试管A小火加热3~5min后,改用大火加热,当观察到B试管中有明显现象时停止实验。试回答:
(1)写出下列物质的化学式(不用指出浓度)
甲 乙
丙 丁
(2)甲物质所含官能团的名称为
(3)写出试管A中发生反应的化学方程式
(4)若用18O标记乙醇中的氧元素,则18O会出现在哪种生成物中?
(5)试管甲中加入浓硫酸的主要目的是
(6)B中长导管不宜伸入试管的溶液中,原因是
(7)B中使用丁溶液的作用是
(17分)某课外小组设计的实验室制取乙酸乙酯的装置如图14-2所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。
已知①无水氯化钙可与乙醇形成难溶于水的CaCl2·6 C2H50H
②有关有机物的沸点:
| 试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点/℃ |
34.7 |
78.5 |
118 |
77.1 |
第5页
请回答:
(1)浓硫酸的作用是 ;若用同位素180示踪法确定反应产物水分子中氧原子的提供者,写出能表示180位置的化学方程式: 。
(2)球形干燥管C的作用是 。若反应前向D中加入几滴酚酞,溶液呈红色,产生此现象的原因是(用离子方程式表示) ;反应结束震荡静止后D中的现象是 .
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出 ;再加入(此空从下列选项中选择) ,然后进行蒸馏,收集77℃左右的馏分,以得较纯净的乙酸乙酯。
| A.五氧化二磷 | B.碱石灰 | C.无水硫酸钠 | D.生石灰 |
(4)有同学拟通过红外光谱仪鉴定所得产物中是否含有“-CH2CH3”,来确定副产物中存在乙醚。请你对该同学的观点进行评价: 。
取wg含有杂质(杂质受热不分解)的NH4HCO3,选用如图所示的装置,制取一瓶干燥的氨气,多余氨气全部被水吸收。回答:
(1)选用的装置是(用A、B、C……回答) ,连接选取装置的正确顺序是(a,b,c……填写): 接 ; 接 ; 接 。
(2)E装置中所盛药品的名称是 ,其作用是 。
(3)若选用B装置,连接时b口进气还是C口进气 ,其原因是 。
(4)若收集到氨气VmL(标准状况),氨水的浓度为a mol/L,则碳酸氢铵的纯度为
%(设NH4HCO3全部分解)。
用一种试剂除去下列各气体中的杂质(括号内为杂质):
(1)CO2(SO2):试剂 ,离子方程式
(2)SO2(HCl):试剂 ,离子方程式
某化学兴趣小组的同学利用下图所示实验装置进行NH3、Cl2的制备、性质等实验(图中夹持装置有省略)。请按要求填空。
供选择的装置:
(1)装置A除可制备NH3外,还可制备其他多种气体,写出制备其中一种气体的化学方程式_____________ ________________________。
(2)为制取干燥氨气,可将装置A与装置________(填编号,从供选择的装置中选取)连接;装置A中的烧瓶内固体宜选用 (选填以下选项的代号)。
a.碱石灰 b.氯化钙 c.五氧化二磷 d.生石灰
(3)若欲制取纯净、干燥的氯气,可从I、II、III装置中选取合适的装置与C依次相连。则连接次序为C、_______(填编号);
(4)B为探究氯气与氨气反应的装置。实验时先向B通入氨气,然后关闭c活塞,再向B通入氯气。
①实验中装置B的烧瓶内出现浓厚的白烟并在容器内壁凝结,试推测发生反应的化学方程式_____________________________,请设计一个实验方案鉴定该固体中的阳离子 ;
②实验完毕后观察到B烧瓶内还有黄绿色气体,简述如何处理才能不污染环境 。
实验室用下图所示装置制备干燥纯净的氯气,并进行氯气的性质实验。请回答下列问题:
(1)A中盛有浓盐酸,B中盛有MnO2,则烧瓶中发生反应的化学方程式为:
 (2)C中盛有饱和食盐水,其作用是 ,D中浓硫酸的作用是 。
(2)C中盛有饱和食盐水,其作用是 ,D中浓硫酸的作用是 。
(3)F中是FeCl2溶液,F中发生反应的离子方程式为
(4)G中是AgNO溶液,现象是
(5)H中盛有Na0H溶液,其作用是 。
某研究性学习小组查阅资料得知:漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(C1O)2+CaCl2+H2SO4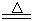 2CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质。
2CaSO4+2Cl2↑+2H2O,该组学生针对上述反应设计如下装置来制取氯气并验证其性质。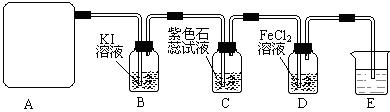
试回答下列问题:
(1)每生成1 mol Cl2,上述化学反应中转移的电子个数为______ (NA表示阿伏加德罗常数)。
(2)该实验中A处可选用装置__________ _____ (填写装置的序号)。
(3)装置B中发生反应的离子方程式为________________________________________。
(4)装置C中的现象为___________________________________________________,
试结合反应方程式解释其原因 __________________________________ _
_________________________________ 。
(5)装置E中的试剂是______________(任填一种合适试剂的名称),其作用是________
_______________________________ ______。
(6)请帮助该学习小组同学设计一个实验,证明装置D中有FeCl3生成(请简述实验 步骤)
步骤)
_________________________________________________________________________
_________________________ __________________________ ______________
__________________________ ______________
乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室用乙酸与乙醇反应制备乙酸乙酯。为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,某同学利用上图所示装置进行了以下四个实验 ,实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
,实验开始先用酒精灯微热3min,再加热使之微微沸腾3min。实验结束后充分振荡试管Ⅱ再测有机层的厚度,实验记录如下:
| 实验 编号 |
试管Ⅰ中的试剂 |
试管Ⅱ中试剂 |
测得有机层的厚度/cm |
| A |
2mL乙醇、2mL乙酸、1mL 18mol·L-1浓硫酸 |
|
5.0 |
| B |
3mL乙醇、2mL乙酸 |
0.1 |
|
| C |
3mL乙醇、2mL乙酸、6mL 3mol·L-1硫酸 |
1.2 |
|
| D |
3mL乙醇、2mL乙酸、盐酸 |
1.2 |
(1)试管Ⅱ中试剂的名称为 ,其作用是
,使用干燥管的目的是 。
(2)分析比较实验 (填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。浓硫酸的吸水性能够提高乙酸乙酯产率的原因是 。
(3)实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是 mL和 mol·L-1。