按要求填空:
(1)写出制取氢氧化铁胶体的水解方程式:
(2)有4中混合溶液,分别由等体积0.1mol/L的2种溶液混合而成:①CH3COONa与HCl②CH3COONa与NaOH③CH3COONa与NaCl④CH3COONa与NaHCO3,则c(CH3COO-)从大到小的关系为 。(填序号)。
(3)25℃时,已知0.1mol·L-1 CH3COONa溶液的PH=8,精确表达下列算式的数学结果:
①c(Na+)-c(CH3COO-)= ;②c(OH-)-c(CH3COOH)=
(4)若往Mg(OH)2的悬浊液中逐滴滴入NH4Cl溶液至澄清,该过程中沉淀溶解的离子反应是 。
(1)0.020 mol/L的HCN(aq)与0.020 mol/L NaCN(aq)等体积混合,已知该混合溶液中c(Na+)> c(CN-),用“>、<、=”符号填空
①溶液中c(OH -) c(H +)②c (HCN) c(CN-)
(2)向碳酸钠的浓溶液中逐滴加入稀盐酸,直到不再生成二氧化碳气体为止,则在此过程中,溶液的碳酸氢根离子浓度变化趋势可能是:
(A)逐渐减小;(B)逐渐增大;(C)先逐渐增大,而后减小;(D)先逐渐减小,而后增大
(3)pH值相同的HCl(aq)、H2SO4(aq)、CH3COOH(aq)各100 mL
①三种溶液中物质的量浓度最大的是 。
②分别用0.1 mol/LNaOH(aq)中和,消耗NaOH(aq)最多的是 。
③反应开始时,反应速率 。
A、HCl最快 B、H2SO4最快 C、CH3COOH最快 D、一样快
(4)某温度下,纯水中的c(H+)= 2.0×10-7 mol/L,则此时c(OH -)= mol/L。相同条件下,测得① NaHCO3(aq)② CH3COONa(aq)③ NaClO(aq)三种稀溶液的pH值相同。它们的物质的量浓度由大到小的顺序是 。
根据下列化合物:①H2SO4,②CH3COOH,③NaCl,④NaOH,⑤NH4Cl,⑥NH3•H2O,⑦CH3COONH4,⑧CH3COONa,⑨NH4HSO4, 请回答下列问题:
(1)常温下,pH=10的CH3COONa 溶液中,水电离出来的c(H+)= ;
(2)已知水存在如下平衡: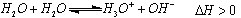 ,现欲使平衡向右移动,
,现欲使平衡向右移动,
且所得溶液显酸性,选择的下列方法是 。
| A.向水中加入NaHSO4固体 | B.向水中加NH4Cl固体 |
| C.加热至100℃ | D.向水中加入NaHCO3固体 |
(3)物质的量浓度相同的①、②、③、④、⑤、⑥六种稀溶液,按pH由大到小的顺序为(填序号) 。
(4)物质的量浓度相同的⑤、⑥、⑦、⑨四种稀溶液中,NH4+浓度由大到小的顺序是(填序号) 。
(5)若浓度均为0.1 mol·L-1、等体积的NaOH和NH3•H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH都变成9,则m_______n(填 “<”、“>”或“=”)。
(6)向NaCl和KBr的混合溶液中加入AgNO3溶液,当两种沉淀共存时,c(Br-)/c(Cl-)=_____________________。
(已知Ksp(AgCl) =2.0×10-10,Ksp(AgBr) =5.4×10-13)
(1)常温下,已知0.1 mol·L-1一元酸HA溶液中c(OH-) / c(H+)=1×10-8。
①常温下,0.1 mol·L-1 HA溶液的pH= ;写出该酸(HA)与NaOH溶液反应的离子方程式: ;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是: 。
(2)常温下,向pH=a的氨水中加入等体积盐酸时,溶液呈中性,则此盐酸的pH 14-a(>、<、=)
(3)向物质的量浓度均为0.01 mol·L-1的MnCl2和BaCl2混合溶液中,滴加Na2CO3溶液,先沉淀的离子是 ,当两种难溶电解质共存时,溶液中c(Ba2+)/c(Mn2+)= 。(此温度下,Ksp(BaCO3)=8.1×10-9、Ksp(MnCO3)=1.8×10-11)
化合物A、B是中学常见的物质,其阴阳离子可从下表中选择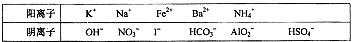
(1)若A、B的水溶液均为无色,B的水溶液呈碱性,且混合后只产生不溶于稀硝酸的白色沉淀及能使红色石蕊试纸变蓝的气体。
①A的化学式为____ ;B的化学式为____;
②A、B溶液混合后加热量中性反应的离子方程式为 。
(2)若A的水溶液呈浅绿色,B的水溶液呈无色且其焰色反应为黄色。向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合亦无明显变化。则
①A为____ ;B为 ;
②经分析上述过程中溶液变黄的原因可能是有两种:
I ;相关的离子反应方程式 。
II ;相关的离子反应方程式 。
某温度(t ℃)时,水的离子积为KW=1.0×10-13mol2·L-2,则该温度(填“大于”、“小于”或“等于”)________25 ℃,其理由是_______________________________________。
若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比:
(1)若所得混合液为中性,则a∶b=________;此溶液中各种离子的浓度由大到小排列顺序是___________________________________。
(2)若所得混合液的pH=2,则a∶b=________。此溶液中各种离子的浓度由大到小排列顺序是__________________________________________。
弱电解质电离情况可以用电离度和电离平衡常数表示,表1是常温下几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1
表2
请回答下面问题:
(1)CH3COONH4的水溶液呈 (选填“酸性”、“中性”或“碱性”),理由是 。溶液中各离子浓度大小关系是 。
(2)物质的量之比为1∶1的NaCN和HCN的混合溶液,其pH>7,该溶液中离子浓度从大到小的排列为 。
胆矾是一种常见的化合物,工业上它也是一种制取其它含铜化合物的原料,现有废铜(主要杂质为Fe)来制备胆矾。有人设计了如下流程: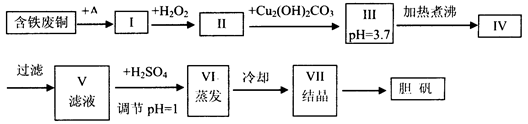
pH值控制可参考下列数据
| 物质 |
开始沉淀时的pH值 |
完全沉淀时的pH值 |
| 氢氧化铁 |
2.7 |
3.7 |
| 氢氧化亚铁 |
7.6 |
9.6 |
| 氢氧化铜 |
5.2 |
6.4 |
请根据上述流程回答下列问题:
(1)A可选用________(填字母)
a.稀H2SO4 b.浓H2SO4、加热 c.浓FeCl3溶液 d.浓HNO3
(2)Ⅰ中加H2O2的目的___________________________________________________。
(3)Ⅱ中加Cu2(OH)2CO3的目的是___________________________________,
其优点是_____________________________________________________________。
(4)Ⅲ加热煮沸时发生的化学反应的离子方程式为___________________________。
(5)V中加H2SO4调节pH=1是为了_________________________________________,
某工程师认为上述流程中所加的A物质并不理想,需作改进,其理由是______________,
若你是工程师,将对所加的A物质作何改进?请提出建议______________________。
常温下,有四种溶液:
| ① |
② |
③ |
④ |
⑤ |
| 0.001mol·L-1 CH3COOH溶液 |
pH=10 NaOH溶液 |
0.001mol·L-1 NaOH溶液 |
pH=4 CH3COOH溶液 |
pH=4 NH4Cl溶液 |
回答下列问题:
(1)①稀释到原来的10倍后的溶液pH ④溶液的pH。 (填“>”或“=”或“<”等,下同)。
(2)④和⑤两溶液中水电离出的c(H+):④ ⑤。
(3)①与③混合,若溶液pH=7,则两溶液体积关系为V(NaOH) ______V(CH3COOH)。
(4)②与④等体积混合,则溶液pH 7,其所得溶液中的溶质组成可能为: 。
研究化学反应原理对于生产、生活及环境保护具有重要意义。
(1)工业制硫酸的过程中存在反应: 。
。 ℃时,将2mol
℃时,将2mol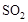 和1.5 mol
和1.5 mol 充入2L密闭容器中发生上述反应,容器中
充入2L密闭容器中发生上述反应,容器中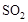 的物质的量随温度变化的曲线如图所示。
的物质的量随温度变化的曲线如图所示。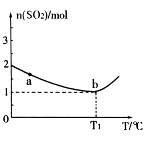
①图中a点的正反应速率 (填写“>”“<”或
“=”)逆反应速率。
②下列条件可以证明上述反应已经达到化学平衡状态的是 (填写序号)
a.单位时间内消耗1mol ,同时生成2mol
,同时生成2mol
b.容器内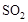 、
、 、
、 的浓度之比为2∶1∶2
的浓度之比为2∶1∶2
c.容器内压强保持不变
d.混合气体的平均相对分子质量保持不变
③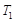 ℃时,上述反应的化学平衡常数K= 。
℃时,上述反应的化学平衡常数K= 。
(2)碳酸铵是一种常用的铵态氮肥,其水溶液显碱性,其原因是 ;溶液中离子浓度关系为 。
。
(3)治理水体重金属离子污染时,首先投入沉淀剂将重金属离子转化为难溶悬浮物,然后再投入氯化铝将污水中的悬浮物除去,从而净化水体,氯化铝的作用是
(用离子方程式表示)。
在a、b两支试管中,分别装入足量Na2CO3粉末,然后向两支试管中分别加入相同物质的量浓度、相同体积的稀盐酸和稀醋酸。填写下列空白。
(1)a、b两支试管中的现象:相同点是__________,不同点是__________________。原因是__________________。
(2)a、b两支试管中生成气体的速率开始时是a__________b,反应完毕后生成气体的总体积是a__________b,原因是__________________。
(1)将0.15 mol·L-1稀硫酸V1 mL与0.1 mol·L-1 NaOH溶液V2 mL混合,所得溶液的pH为1,则V1∶V2=________。(溶液体积变化忽略不计)
(2)室温下,某水溶液中存在的离子有:Na+、A-、H+、OH-,根据题意,回答下列问题:
①若由0.1 mol·L-1 HA溶液与0.1 mol·L-1 NaOH溶液等体积混合而得,则溶液的pH________7。
②若溶液pH>7,则c(Na+)________c(A-),理由是____________________________________。
③若溶液由pH=3的HA溶液V1 mL与pH=11的NaOH溶液V2 mL混合而得,则下列说法正确的是________(填选项代号)。
| A.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7 mol·L-1 |
| B.若V1=V2,反应后溶液的pH一定等于7 |
| C.若反应后溶液呈酸性,则V1一定大于V2 |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
食盐中的抗结剂是亚铁氰化钾,其化学式为K4[Fe(CN)6] •3H2O。
42.2g K4[Fe(CN)6] •3H2O样品受热脱水过程的热重曲线(样品质量随温度的变化曲线)如下图所示。试回答下列问题: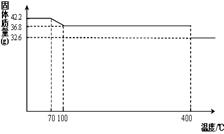
(1)试确定150℃时固体物质的化学式为_______________。
(2)查阅资料知:虽然亚铁氰化钾自身毒性很低,但其水溶液与酸反应放出极毒的氰化氢(HCN)气体;亚铁氰化钾加热至一定温度时能分解产生氰化钾(KCN)。据此判断,烹饪食品时应注意的问题为___________________________________。
(3)在25℃下,将a mol•L-1的KCN(pH>7)溶液与0.01mol•L-1的盐酸等体积混合,反应平衡时,测得溶液pH=7,则KCN溶液的物质的量浓度a_______0.01mol•L-1(填“>”、“<”或“=”)。
(4)在25℃下,KCN溶液pH=9,c(K+)-c(CN_)="_______" mol•L-1(用数字表示但不需近似计算)。
(5)已知Fe(OH)3的溶度积常数Ksp=1.1×10-38。室温时在FeCl3溶液中滴加NaOH溶液,当溶液中Fe3+沉淀完全时,控制pH应不小于 。
(提示:当某离子浓度小于10-5 mol•L-1时可以认为该离子沉淀完全了;)
常温下,将3种一元酸分别和NaOH溶液等体积混合,实验数据如下:
| 组别 |
一元酸 |
NaOH |
混合溶液的pH |
| 甲 |
c(HX)="0.1" mol/L |
c(NaOH)=0.1mol/L |
pH = a |
| 乙 |
c(HY)=c1 mol/L |
c(NaOH)=0.1mol/L |
pH = 7 |
| 丙 |
c(HZ)="0.1" mol/L |
c(NaOH)=0.1mol/L |
pH = 9 |
| 丁 |
pH=2 HZ |
pH=12 NaOH |
pH = b |
(1)甲组实验中HX为弱酸,a 7(填“<”,“=”或“>”),
混合溶液中离子浓度由大到小顺序为 。
(2)乙组实验中HY为强酸,则HY溶液的pH= 。
(3)丙组实验发生反应的离子方程式为 ,
所得溶液中由水电离出的c (OH-) = mol/L。
(4)丁组实验中b 7(填“<”,“=”或“>”)。