(1)25℃,柠檬水的pH是3,其中c(OH-)==
(2)下列溶液中,c(H+)由小到大的排列顺序是
① 0.1mol/L HCl 溶液 ② 0.1mol/L H2SO4溶液
③ 0.1mol/L NaOH溶液 ④0.1mol/L CH3COOH溶液
(3)在25℃时,1mol· L-1的①(NH4)2SO4 ②CH3COONH4 ③(NH4)2Fe(SO4)2 ④NH4Cl的溶液中,c(NH4+)由大到小的顺序为
(4)pH=3盐酸和pH=11氨水等体积混合后溶液呈 性(选填“酸”、“中”或“碱”),溶液中c(NH4+) c(Cl-)(选填“ >”“=”“<” )。
工业常利用CO来制氢气。已知在25℃时:
C(s,石墨) + 1/2 O2(g) =" CO(g) " △H1= -111kJ/mol
H2(g) + 1/2 O2(g) = H2O(g) △H2= -242kJ/mol
C(s,石墨) + O2(g) = CO2(g) △H3= -394kJ/mol
(1)在25℃时,CO(g) + H2O(g)  CO2(g) + H2(g) △H=_____________。
CO2(g) + H2(g) △H=_____________。
(2)在2L密闭容器中,将2 mol CO与3 mol H2O混合加热到800℃,发生下列反应:CO(g)+H2O(g) CO2(g)+H2(g) K=1.0。则平衡后CO的转化率为_______,平衡混合物中H2的体积分数为_______。
CO2(g)+H2(g) K=1.0。则平衡后CO的转化率为_______,平衡混合物中H2的体积分数为_______。
(3)将(2)中的平衡后的混合气体通入300mL 6mol/L NaOH溶液中,充分吸收,所得溶液中离子浓度由大到小的顺序为____________________________________ _____________。
_____________。
(4)将(3)中剩余的气体通过足量浓硫酸后,再与足量氧气用电火花引燃后通入足量的过氧化钠中,过氧化钠的质量增重______g。
(5)工业上也可以用CO和H2生产甲醇:CO(g) + 2H2 (g) = CH3OH (g),在一定条件下,该反应在一个密闭容器中达到平衡,若维持c(H2)和容器的温度不变,
(g) = CH3OH (g),在一定条件下,该反应在一个密闭容器中达到平衡,若维持c(H2)和容器的温度不变, 增大容器的体积,则平衡_________(填字母)
增大容器的体积,则平衡_________(填字母)
| A.不移动 | B.向正反应方向移动 |
| C.向逆反应方向移动 | D.无法判断移动的方向 |
分析、归纳、探究是学习化学的重要方法和手段之一.下面就电解质A回答有关问题(假定以下都是室温时的溶液)。
(1)电解质A的化学式为NanB,测得浓度为c mol/L的A溶液的pH=a
①当a=10时,A溶液呈碱性的原因是(用离子方式程式表示) 。
②当a=10,n=1时,A溶液中各种离子浓度由大到小的顺序为 ,
c(OH-)-c(HB)=________ mol/L。
③当n=1、c=0.1、溶液中c(HB)∶c(B-)=1∶99时,A溶液的pH为______(保留整数值)。
(2)已知难溶电解质A的化学式为XnYm,相对分子质量为M,测得其饱和溶液的密度为ρ g/cm3,Xm+离子的浓度为c mol/L,则该难溶物XnYm的溶度积常数为Ksp=_____________,该温度下XnYm的溶解度S=____________g
将某一元酸HA与NaOH等体积混合,请根据题目要求回答下列问题:
(1)若c(HA)=c(NaOH)=O.lmol/L,测得混合后溶液的pH>7。
①HA是弱电解质,能证明HA是弱电解质的方法是( )。
A测得0. Imol/L HA的pH>l B.测得NaA溶液的pH>7
C.pH=l的HA与盐酸,稀释10倍后,盐酸的pH变化大
D.用足量的锌分别与相同pH、相同体积的盐酸和HA反应,产生氢气一样多
②混合溶液中,关系式一定正确的是( )。
A.c(A-)>c(Na+)c(OH-)>c(H+) B.c(A-)+c(OH-)=c(Na+)+c(H+)
C.c(HA)+c(A-)=0.1mol/L D.C( HA) +c( H+)= c(OH-)
③若HA(足量)+B2一 A一+HB-;H2B(少量)+2C- B2-+2HC: HA+C- A-十HC
则相同pH的①NaA②Na2B③NaHB④NaC的四种溶液,各物质的物质的量浓度从大到小的顺序为
(填序号)。
(2)若c( HA)==c(NaOH)==0.1mol/L,测得混合后溶液的pH=7。
①现将一定浓度的HA稀释10倍后溶液的pH与该浓度的HA和0.1 mol/L NaOH等体积混合后溶液的pH相等,则HA溶液的浓度为 。
②用标准的NaOH溶液滴定未知浓度的HA时,下列操作能引起所测HA浓度偏低的是 。
A.用蒸馏水洗涤锥形瓶后,用待测HA溶液进行润洗
B.滴定前发现滴定管的尖嘴部分有气泡,滴定后消失
C.装NaOH的碱式滴定管未用标准的NaOH溶液润洗
D.滴定前仰视,滴定后俯视读数
(4分) 25℃时,①氢氟酸、②醋酸、③次氯酸的电离常数分别是3.5×10-4、1.8×10-5、3.0×10-8。请推测:它们的酸性由强到弱的顺序为______________________(填序号,下同),相同浓度的溶液中,氢离子浓度最大的是__________,电离程度最小的是_______;相同浓度的④氟化钠溶液、⑤醋酸钠溶液、⑥次氯酸钠溶液pH的从大到小顺序:_____________________________。
(14分)常温下,将某一元酸 和
和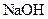 溶液等体积混合,混合前两种溶液的浓度和混合后所得溶液的
溶液等体积混合,混合前两种溶液的浓度和混合后所得溶液的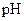 如下表(设混合后溶液体积变化忽略不计):
如下表(设混合后溶液体积变化忽略不计):
| 实验编号 |
 物质的量浓度 物质的量浓度( 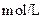 ) ) |
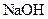 物质的量浓度 物质的量浓度( 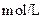 ) ) |
混合溶液的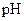 |
| 甲 |
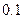 |
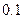 |
 |
| 乙 |
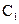 |
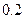 |
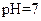 |
| 丙 |
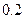 |
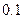 |
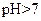 |
| 丁 |
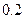 |
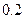 |
 |
请回答;
(1)仅依据甲组数据分析, 的取值范围为 。
的取值范围为 。
(2)从乙组情况分析,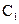 是否一定等于
是否一定等于 (选填“是”或“否”)。若
(选填“是”或“否”)。若 为弱酸,计算出该混合溶液达平衡时
为弱酸,计算出该混合溶液达平衡时 电离常数
电离常数 的近似值是 (用含
的近似值是 (用含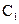 代数式表示)。
代数式表示)。
(3)丙组混合溶液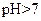 的原因是 ,该组混合溶液中离子浓度的大小关系是 。
的原因是 ,该组混合溶液中离子浓度的大小关系是 。
(4)若把某离子水解的物质的量占某离子总物质的量的百分数叫做“水解度”,依据丁组数据,推知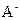 在该条件下的水解度是 ,该溶液中,水电离出的
在该条件下的水解度是 ,该溶液中,水电离出的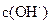 是
是 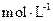 。
。
下列溶液中微粒的物质的量浓度关系正确的是
A.向硝酸钙溶液里滴加稀盐酸得到pH=4的溶液中: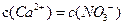 |
| B.将0.2 mol·L-1NaA溶液和0.1 mol·L-1盐酸等体积混合所得的碱性溶液中(A- 为酸根离子):c(Na+)>c(AlO2-)>c(C1-)>c(0H-) |
| C.0.1 mol/L-1NaAl02溶液中:c(Na+)>c(AlO2-)>c(OH-)>c(H+) |
| D.浓度均为0.1 mol·L-1的CH3COOH、CH3COONa的混合溶液中: |
2c(OH-)=2c(H+)+c(CH3COOH)
为减小和消除CO2对环境的影响,有科学家提出“绿色自由”构想。即先把空气吹人碳酸钾溶液,然后再把CO2从溶液中提取出来,并使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下: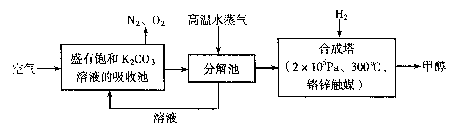
(1)写出分解池中反应的化学方程式 。
(2)在合成塔中,当有4.4kg CO2与足量H2完全反应,可放出热量4947 kJ,写出合成塔中反应的热化学方程式 。
(3)写出以氢氧化钾为电解质的甲醇燃料电池的负极反应式 。
当电子转移为 mol时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)在体积为l L的密闭容器中,充人1mol CO2和3molH2在500°C下发生反应。有关物质的浓度随时问变化如下图所示。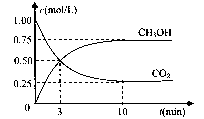
①从反应开始到平衡,H2的平均反应速率v(H2)= 。
②若其他条件不变,只将温度提高到800°C,再次达平衡时,n(CH3OH)/n(CO2)比值 (填“增大”、“减小”或“不变”)。
已知某温度下,KW=1×10-13。A为酸溶液,其pH=a;B为碱溶液,其pH=b。
(1)若A为强酸,B为强碱,且a+b=13,两者等体积混合后,溶液的pH=________;若此时溶液中碱的阳离子浓度大于酸根阴离子浓度,其原因可能是(用文字表述)_____________________。
(2)若A为强酸,B为强碱,二者按体积比为1:10混合后溶液显中性,则a+b=____。
(3)若A的化学式为HR,B的化学式为MOH,且a+b=13,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为_________________________________。
(4)在(3)的混合溶液中,微粒浓度大小关系一定正确的是___________(填序号)。
①c(MOH)>c(M+)>C(R-)>c(H+)>c(OH-)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+)>c(OH-)
④c(M+)>c(R-)>c(OH-)>c(H+)
⑤c(M+)+ c(H+)=c(R-)+c(OH-)
⑥c(MOH)=c(H+)-c(OH-)
某温度(t℃)时,水的Kw=1×10-12,则该温度(填“>”、“<”或“=”) 25℃,其理由是
。
⑴将此温度下pH=11的NaOH与pH="1" HCl等体积混合,混合后溶液pH= ;
⑵将此温度下pH=9的Ba(OH)2溶液取出1mL,加水稀释至10000mL,则稀释后溶液
c(Ba2+)﹕c(OH-)= ;
⑶将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4溶液bL混合:
①若所得混合液为中性,则a﹕b= ;
②若所得混合液的pH=2,则a﹕b= 
某混合碱是①Na2CO3和NaHCO3或② Na2CO3和 NaOH。用“双指示剂法”对样品的组分和总碱量 [n (Na2O) ] 进行测定。实验方案:称取 0.2960g 样品配成 500mL 溶液,取25.00mL置于250mL 锥形瓶中,加适量蒸馆水和几滴酚酞,用0.0100 mol•L-1的盐酸标准溶液将混合碱滴定成NaHCO3,然后再用溴甲酚绿——二甲基黄为指示剂进行滴定,将NaHCO3完全中和。
(1)某同学平行滴定了三次,每次滴定从 "0" 点开始读数,其中第 I 次滴定的第一个终点的液面如右图所示,请读出实验数据,填入下列表格中
| 序号 |
第一滴定终点的读数(V1/mL) |
第二滴定终点的读数(V2/mL) |
| I |
? |
26.85 |
| II |
10.02 |
25.02 |
| III |
9.98 |
24.98 |
(2)该混合碱样品的组成为 ,理由 。
(3)将混合碱滴定成NaHCO3的过程中,为了结果更加准确,应始终逐滴滴加,这样操作的原因是 。
(4)上述碱样中总碱量[n (Na2O) ]是多少?写出计算过程
。
(5)如果本实验只测定样品的总碱量,实验方案应该怎样设计:
。
(Ⅰ)常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
| 实验编号 |
HA的物质的量 浓度(mol·L-1) |
NaOH的物质的量 浓度(mol·L-1) |
混合后 溶液的pH |
| 甲 |
0.1 |
0.1 |
pH=a |
| 乙 |
0.12 |
0.1 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=10 |
(1)从甲组情况分析,如何判断HA是强酸还是弱酸? ▲ 。
(2)乙组混合溶液中离子浓度c(A—)和c(Na+)的大小关系是 ▲ 。
A.前者大 B. 后者大 C. 二者相等 D.无法判断
(3)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 ▲ 。
(4)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):
c(Na+)—c(A-)= ▲ mol·L-1
(Ⅱ)某二元酸(化学式用H2B表示)在水中的电离方程式是:
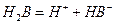

回答下列问题:
(5)在0.1mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 ▲ 。
A.c( B2—)+c(HB—)=0.1mol/L B.c( B2—)+ c(HB—)+c(H2B)=0.1mol/L
C c(OH—)=c(H+)+ c(HB—) D.c(Na+)+c(OH)=c(H+)+ c(HB—)
已知H2B在水溶液中存在以下电离:

 一级电离:H2B H++HB-,二级电离:HB- H++B2-
一级电离:H2B H++HB-,二级电离:HB- H++B2-
请回答以下问题:
(1)NaHB溶液 (填“呈酸性”、“呈碱性”或“无法确定”),原因是
。
(2)若0.1mol·L-1的H2B溶液在某温度下的pH=3,c(B2-)=1×10-6mol·L-1,则H2B的一级电离的电离度为 。
(3)某温度下,在0.1mol·L-1的NaHB溶液中,以下关系一定不正确的是 ( )
A.c(H+)·c(OH-)=1×10-14
B.pH>1
C.c(OH-)=2c(H2B)+c(HB-)+c(H+)
D.c(Na+)=0.1mol·L-1≥c(B2-)
|
 (4)某温度下,FeB(s) Fe2+(aq)+B2-(aq)
(4)某温度下,FeB(s) Fe2+(aq)+B2-(aq)