(6分)某课外活动小组同学用如图装置进行实验,试回答下列问题。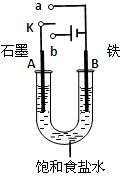
(1)若开始时开关K与b连接,则B极的电极反应式为 。
总反应的离子方程式为 。
有关上述实验,下列说法正确的是(填序号) 。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质相同的状态(质量和浓度均相同)
④若标准状况下B极产生2.24 L气体,则电路中转移0.2 mol电子
(2)若开始时开关K与a连接,则B极的电极反应式为
。
运用相关原理,回答下列各小题:
已知: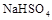 在水中的电离方程式为
在水中的电离方程式为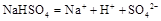
(1)常温下,PH=5的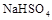 溶液中水的电离程度 PH=9的
溶液中水的电离程度 PH=9的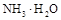 中水的电离程度。(填“>”、”=”或“<”)
中水的电离程度。(填“>”、”=”或“<”)
(2)等体积等物质的量浓度的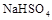 与氨水混合后,溶液呈酸性的原因为 。(用离子方程式表示);若一定量的
与氨水混合后,溶液呈酸性的原因为 。(用离子方程式表示);若一定量的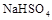 溶液与氨水混合后,溶液PH=7,则
溶液与氨水混合后,溶液PH=7,则
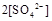 (填“>”、“=”或“<”不同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中
(填“>”、“=”或“<”不同);用硫酸氢钠与氢氧化钡溶液制取硫酸钡,若溶液中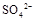 完全沉淀,则反应后溶液的PH= 7(填“>”、”=”或“<”)
完全沉淀,则反应后溶液的PH= 7(填“>”、”=”或“<”)
(3)将分别含有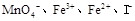 的四种溶液混合,调节溶液的PH值,使PH=1,充分反应后:
的四种溶液混合,调节溶液的PH值,使PH=1,充分反应后:
①若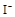 离子有剩余,上述四种离子在溶液中还存在的有 ,一定不存在的是
离子有剩余,上述四种离子在溶液中还存在的有 ,一定不存在的是
②若所得混合液呈紫色,上述四种离子在溶液中一定存在的有 ,
一定不存在的离子有 。
25℃时,电离平衡常数:
化学式 CH3COOH H2CO3 HClO
电离平衡常数 1.8×10-5 K1 4.3×10-7 3.0×10-8
K2 5.6×10-11
回答下列问题:
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,bNaClO,c.CH3COONa
d.NaHCO3;PH由大到小的顺序是:_______________________;(填编号)
(2)常温下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定变小的是:____________________;
| A.c(H+) | B.c(H+)/c(CH3COOH) | C.c(H+)·c(OH-) | D.c(OH-)/(H+) |
(3)体积为10mLPH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程PH变化如图:则HX的电离平衡常数_____(填“大于”、“等于”或“小于”)醋酸的平衡常数;理由是_____________________________________________________________________,稀释后,HX溶液中水电离出来的c(H+)______醋酸溶液水电离出来c(H+)(填“大于”、“等于”或“小于”)理由是:_______________________________________________________;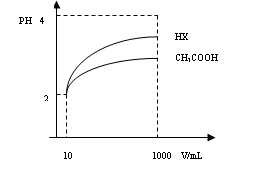
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液PH=6,则溶液中
c(CH3COO-)-c(Na+)=_______________________。(填准确数值)
研究和开发CO2和CO的创新利用是环境保护和资源利用的双赢的课题。
(1)CO可用于合成甲醇。在压强为0.1Mpa条件下,在体积为bL的密闭容器中充入amolCO和2amolH2,在催化剂作用下合成甲醇:
CO(g)+2H2(g) CH3OH(g)平衡时CO的转化率与温度,压强的关系如下图:
CH3OH(g)平衡时CO的转化率与温度,压强的关系如下图: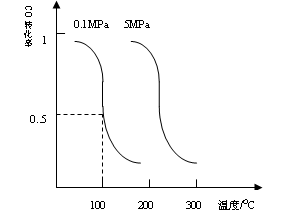
(i)该反应属于_____________反应:(填“吸热”或“放热”)。
(ii)100℃时,该反应的平衡常数:K=_____________;(用a、b的代数式表示)。
若一个可逆反应的平衡常数K值很大,对此反应的说法正确的是:_________________填序号)
| A.该反应使用催化剂意义不大; |
| B.该反应发生将在很短时间内完成; |
| C.该反应达到平衡时至少有一种反应物百分含量很小; |
| D.该反应一定是放热反应; |
(iii)在温度和容积不变的情况下,再向平衡体系中充入amolCO,2amolH2,达到平衡时CO转化率________(填“增大”,“不变”或“减小”,下同)平衡常数:________。
(iv)在某温度下,向一容积不变的密闭容器中充入2.5molCO,7.5molH2,反应生成CH3OH(g),达到平衡时,CO转化率为90%,此时容器内压强为开始时的压强__________倍。
(2)某温度条件下,若将CO2(g)和H2(g)以体积比1:4混合,在适当压强和催化剂作用下可制得甲烷,已知:
CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=-890.3KJ/mol
H2(g)+1/2O2(g)= H2O(l) △H=-285.8KJ/mol
则CO2(g)和H2(g)反应生成液态水的热化学方程式为:_________________________。
按要求写出相应的方程式:
电离方程式:
(1) H2S:
(2) NH4HSO4:
水解反应的离子方程式:
(3)CuSO4:
(4)Na2CO3:
(5)AlCl3+NaHCO3:
醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐。(已知:25℃,Ka(CH3COOH)=1.69×10-5)。 请回答:
⑴写出醋酸钠在水中发生水解反应的离子方程式: ;
⑵在CH3COONa溶液中离子浓度由大到小的顺序为
(用“c(Bn+)”表示相应离子浓度);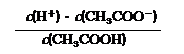
⑶ 25℃时,醋酸的电离平衡常数表达式Ka= 。0.10mol/L的醋酸溶液的pH约为 (提示:醋酸的电离常数很小,平衡时的c(CH3COOH)
可近似视为仍等于0.10mol/L;已知:lg1.3=0.114);
⑷对于醋酸溶液和醋酸钠溶液的下列说法正确的是
A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小。
升高温度可以促进醋酸电离,而升高温度则会抑制醋酸钠水解。
C.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离。
D.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离。
⑸物质的量浓度均为0.1mol/L的CH3COONa和CH3COOH溶液等体积混合(注:混合前后溶液体积变化忽略不计),混合液中的下列关系式正确的是 ;
A.c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-)
B.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.c(CH3COO-)+c(CH3COOH)=0.1mol/L
⑹常温时,有以下3种溶液,其中pH最小的是
⑺已知醋酸能 够和小苏打溶液发生下列反应:
够和小苏打溶液发生下列反应:
CH3COOH+NaHCO3=CH3COONa+CO2↑+H2O 。
用pH试纸在常温下分别测定 0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸氢钠溶液,
0.10mol/L的醋酸钠溶液和0.10mol/L的碳酸氢钠溶液,
则pH(CH3COONa) pH(NaHCO3)。(填:“>”、“<”或“=”)
(1)常温下,有A、B、C、D四种无色溶液,它们分别是CH3COONa溶液、NH4Cl溶液、盐酸和NaNO3溶液中的一种。已知A、B的水溶液中水的电离程度相同,A、C溶液的pH相同。
则: B是____ __溶液(填溶质的化学式,下同),C是______,
(2)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种可能:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
则:(ⅰ)上述关系一定不正确的是__(填序号)。
(ⅱ)若溶液中只有一种溶质,则该溶液中离子浓度的大小关系为__(填上列四种情况之一的序号);
(ⅲ)若四种离子浓度关系有c(NH4+)=" " c(Cl-),则该溶液一定显__(填“酸性”、“碱性”或“中性”)。
常温下有一PH为12的NaOH溶液100mL,如果将其PH将为11,那么
(1)若用蒸馏水应加入 mL (2)若用PH=10的NaOH溶液应加入 mL
(3)若用PH=2的盐酸应加入 mL (4)若用0.01mol/L的硫酸溶液应加入 mL
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为__ (填序号)。
| A.9 | B.13 | C.11~13之间 | D.9~11之间 |
(2)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,混合溶液中
c(Na+)_______c(CH3COO-) ( “>”、“=”或“<”)。
(3)常温下,0.10mol/LNH4Cl溶液中各离子浓度由大到小的顺序是_____________ _。
(4)将NaHCO3溶液跟Al2(SO4)3溶液混合,现象是 ,相关反应的离子方程式是 。
(7分) 由Cl-、Br-、CO32-、SO32-、SO42-、Na+、Fe3+中若干种离子组成的化合物溶于水后得无色溶液,然后依次进行实验,观察到的现象记录如下:
①向溶液中加足量新制饱和的氯水,溶液变黄,无气体产生,再加入汽油振荡,静置,汽油层呈橙红色,用分液漏斗分离。
②向分液后所得的水溶液中加入BaCl2和盐酸的混合溶液,有白色沉淀产生,过滤。
③在滤液中加入AgNO3和HNO3的混合液,有白色沉淀产生。
请认真分析后回答下列问题:
(1)原溶液中是否含有Na+ (填“是”“否”或“无法确定”,下同。),原溶液中是否含有Cl- 。
(2)步骤①中溶液变黄的原因是(用离子方程式表示):
______________________________________________________________________。
(3)原溶液中是否含有SO32-、SO42-: (填“都有”、“都没有”、“仅有一种”或“至少有一种”)。理由是_____________________________________________________。
在常温下,用一定浓度的CH3COOH溶液滴定V mL同浓度NaOH溶液时得到的滴定曲线如下图: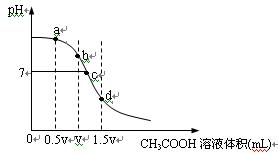
经测定某溶液中只含有Na+、CHCOO-、H+、OH- 四种离子,已知这种溶液含有一种或两种溶质。查资料表明等浓度的CH3COOH和CH3COONa的混合液显酸性。试完成下列各题:
(1)试分析上图所表示滴定过程的b、d两点可能的溶质组合:
b点_____________________,d点____________________。
(2)分别指出上图a、c两点所存在的微粒的离子浓度大小关系:
a点:_________________________________________________________________________
c点:_________________________________________________________________________
(3)水的电离程度与溶液中所溶解的电解质有关,试分析上图a、b、c、d点,水的电离程度最大的是______。
(4)有关这种溶液,下列的说法不正确的是_________
| A.若溶液中粒子间满足:c(Na+)>c(CH3COO-)>c(OH-)>c(H+),则溶液中溶质可能为CH3COONa和NaOH |
| B.若溶液中粒子间满足c(CH3COO-)>c(Na+)>c(H+)>c (OH-),则溶液中溶质一定只有CH3COONa |
| C.若溶液中c(Na+)=c(CH3COO-),则该溶液一定显中性 |
| D.若溶液中c(CH3COOH)>c(Na+),则溶液一定显酸性 |
E.溶液中离子间可能满足c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
(5)若溶液是由体积相等的CH3COOH溶液和NaOH溶液混合而成,且恰好呈中性,则混合前c(CH3COOH)____________c(NaOH)(填“>”“<”或“=”)。
(1)某温度(t℃)时,水的Kw=10-13mol2·L-2,则该温度(填大于、小于或等于) 25℃,其理由是 。
(2)将此温度下pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合,则:
①若所得混合液为中性,则a∶b= ;
②若所得混合液的pH=2,则a∶b= ;
饮用水安全状况与人类健康有着密切关系。重金属离子对河流、海洋会造成严重污染。沉淀法是处理含重金属离子污水常用的方法。
某工厂废水(pH=2.0,ρ=1.0 g·mL-1)中含Ag+、Pb2+等重金属离子,其浓度各约为0.01mol·L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
| 难溶电解质 |
AgCl |
AgI |
AgOH |
Ag2S |
PbI2 |
Pb(OH)2 |
PbS |
| Ksp |
1.8×10-10 |
8.3×10-17 |
5.6×10-18 |
6.3×10-50 |
7.1×10-9 |
1.2×10-15 |
3.4×10-28 |
(1)你认为往废水中投 (填字母序号),沉淀效果最好。
| A.NaOH | B.Na2S | C.KI | D.Ca(OH)2 |
 (2)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)= 。
(2)如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)= 。 (3)如果用食盐处理其只含银离子的废水,测得处理后的废水中NaCl的质量分数为0.117%,若环境要求排放标准为c(Ag+)低于1.0×10-18mol·L-1,则该工厂处理后的废水是否符合排放标准 。
(3)如果用食盐处理其只含银离子的废水,测得处理后的废水中NaCl的质量分数为0.117%,若环境要求排放标准为c(Ag+)低于1.0×10-18mol·L-1,则该工厂处理后的废水是否符合排放标准 。 (填“是”或 “否”)写出计算过程。
(填“是”或 “否”)写出计算过程。
水的电离平衡曲线如图所示: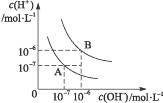
(1)若以A点表示25 ℃时水的电离平衡时的离子浓度,当温度升高到100 ℃时,水的电离平衡状态到B点,则此时水的离子积从____________________增加到_____________________。
(2)将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100 ℃的恒温,致使混合液的pH=7,则Ba(OH)2与盐酸的体积之比为________________________________。
(3)已知AnBm的离子积=[C(Am+)]n·[C(Bn-)]m,式中的C(Am+)、C(Bn-)表示离子的物质的量浓度。若某温度下CA(OH)2溶解度为0.74 g,其饱和溶液密度设为1 g·mL-1,其离子积约为_____________________________________________。