北京市宣武区高三第二次模拟考试(理综)化学部分
下列说法正确的是 ( )
| A.味觉上有酸味的食物即酸性食物 |
| B.生石灰可防止食物受潮,铁粉可防止食物氧化变质 |
| C.油脂、淀粉、蛋白质和维生素等均为高分子化合物 |
| D.食品添加剂苯甲酸钠是苯的一种同系物所对应的钠盐 |
下列说法正确的是 ( )
| A.含10.6 g Na2CO3的溶液中,所含阴离子总数等于6.02×1022 |
| B.28 g由乙烯和氮气组成的混合气体中,含有6.02×1023个原子 |
| C.电解法精炼铜,当阴极质量增加32 g时,有6.02×1023个电子转移 |
| D.含0.2 mol H2SO4的浓硫酸与足量铜反应,生成SO2的分子数为6.02×1022 |
向25.00mL 0.10mo/L NaOH溶液中逐滴加入0.10mol/L CO3COOH溶液,溶液pH变化曲线如图所示,下列有关判断错误的是 ( )
| A.在A点,溶液的pH=13 |
| B.在B点,c(Na+)=c(CH3COO一)>c(OH一)=c(H+) |
| C.在C点,c(Na+)>c(CH3COO-)>c(H+)>c(OH一) |
| D.在D点,c(CH3COO-)+c(CH3COOH)=2c(Na+) |
某脂肪酸的两种异构体结构简式如图所示
下列叙述错误的是 ( )
| A.该脂肪酸含有羧基和碳碳双键两种官能团 |
| B.(1)式为顺式结构,(2)式为反式结构 |
| C.该脂肪酸最简单的同系物是CH2=CH-COOH |
| D.(1)和(2)分别与氢气加成,所得产物不同 |
在恒温容器中,可逆反应C(s)+H2O(g) CO(g)+H2(g)一定达平衡状态的是 ( )
CO(g)+H2(g)一定达平衡状态的是 ( )
| A.气体的压强不变 |
| B.气体的体积不变 |
| C.混合气的密度不变 |
| D.有n个H—O键断裂的同时有n个H—H键断裂 |
关于下列装置用途的判断正确的是 ( )
①装置甲可防止铁钉生锈 ②装置乙可除去乙烯中混有的SO2
③装置丙可检验NH3在水中的溶解性 ④装置丁可用于实验室制取乙酸乙酯
⑤装置戊可用于收集H2、CO2、Cl2、CHl、NO2等气体
| A.只有③④ | B.只有③⑤ | C.只有①③⑤ | D.只有①②④ |
含有1mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示。下列有关判断正确的是 ( )
| A.a是Fe(NO3)2 |
| B.n1=0.375 |
| C.P=0.125 |
| D.n2=0.30 |
以A和乙醇为有机基础原料,合成香料甲的流程图如下:
已知:R—Br+NaCN→R→CN+NaBr;
杏仁中含有A,A能发生银镜反应。质谱测定,A的相对分子质量为106。5.3g A完全
燃烧时,生成15.4g CO:和2.7g HO。
(1)A的分子式为 ,A发生银镜反应的化学方程式为 。
(2)写出反应②的化学方程式 。
(3)上述反应中属于取代反应的是: 。
(4)符合下列条件的E的同分异构体有 种;
a.能发生银镜反应 b.不含Cu c.不能水解
写出其中2种结构简式 。
(5)写出反应⑤的化学方程式 。
X、Y、Z、W四种短周期元素在周期表中的位置关系如图:
I.若Z元素原子的最外层电子数是电子层数的2倍
(1)W在周期表中的位置为 。
(2)Y和Z可组成的化合物的化学式为 。
(3)写出铜和X的最高价氧化物水化物稀溶液反应的离子方程式 。
(4)W最高价氧化物水化物的浓溶液不稳定,受热可分解,产物之一是黄绿色气体,且当有28mol电子转移时,共产生9mol气体,写出该反应的化学方程式 。
II.若Y和z的核外电子数之和为22
(1)Y的气态氢化物电子式为 ,工业合成该物质的化学方程式为 。
(2)将X的最高价氧化物通人到苯酚钠溶液中,实验现象是 。
(3)X单质与W的最高价氧化物水化物的浓溶液反应,当电:子转移0.4mol时,产生气体的体积(标准状况下)是 。
为减小和消除CO2对环境的影响,有科学家提出“绿色自由”构想。即先把空气吹人碳酸钾溶液,然后再把CO2从溶液中提取出来,并使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下: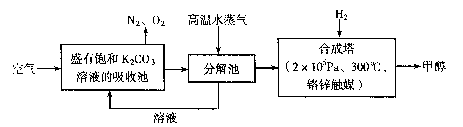
(1)写出分解池中反应的化学方程式 。
(2)在合成塔中,当有4.4kg CO2与足量H2完全反应,可放出热量4947 kJ,写出合成塔中反应的热化学方程式 。
(3)写出以氢氧化钾为电解质的甲醇燃料电池的负极反应式 。
当电子转移为 mol时,参加反应的氧气的体积是6.72L(标准状况下)。
(4)在体积为l L的密闭容器中,充人1mol CO2和3molH2在500°C下发生反应。有关物质的浓度随时问变化如下图所示。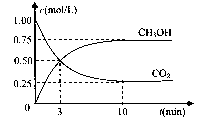
①从反应开始到平衡,H2的平均反应速率v(H2)= 。
②若其他条件不变,只将温度提高到800°C,再次达平衡时,n(CH3OH)/n(CO2)比值 (填“增大”、“减小”或“不变”)。
(J4分)
二氧化锰(MnO2)与浓盐酸混合加热可得到氯气、氯化锰等,下图是制取并探究Cl2化学性质的装置图。
(1)已知锰元素的常见化合价为+7、+6、+4、+2,写出圆底烧瓶中反应的化学方程式
。
(2)A中m管的作用是 ,装置F的作用是 。
(3)若要得到干燥纯净的气体,则B中应盛放的试剂是 。
(4)E中若装有FeCl2溶液,反应的离子方程式为 ;E中若装有淀粉碘化钾溶液,能观察到的实验现象是 。
(5)实验中发现:浓盐酸与Mn0:混合加热生成氯气,稀盐酸与Mn0:混合加热不生成氯气。针对上述现象,化学小组对“影响氯气生成的原因”进行了讨论,并设计了以下实验方案:
a.稀盐酸滴入MnO2中,然后通人HCl气体,加热
b.稀盐酸滴人MnO2中,然后加入NaCl固体,加热
c.稀盐酸滴入MnO2中,然后加入浓硫酸,加热
d.Mn02与NaCl的浓溶液混合,加热
e.浓硫酸与NaCl固体、MnO2固体共热
①实验b的目的是 ;实验c的目的是 。
②实验现象:a、c、e有黄绿色气体生成,b、d没有黄绿色气体生成。由此得出影响氯气生成的原因是 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号