24mL浓度为0.05mol/L 的Na2SO3溶液恰好与20mL浓度为0.02 mol/L的K2Cr2O7溶液完全反应;已知Na2SO3被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为
| A.+2 | B.+3 | C.+4 | D.+5 |
研究性学习小组进行了一系列化学实验后,发现高锰酸钾分解后的含锰元素的化合物都能和浓盐酸反应制得氯气,且锰化合物的还原产物都是MnCl2.他们将6.32gKMnO4粉末加热一段时间,也不知道高锰酸钾是否完全分解,收集到0.112L气体后便停止加热了,冷却后放入足量的浓盐酸再加热,又收集到气体体积是(上述气体体积都折合成标准状况)
| A.0.448L | B.2.240L | C.2.016L | D.无法确定 |
某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物,当参加反应的单质与被还原HNO3的物质的量之比为2∶1时,还原产物可能是
| A.N2O | B.NO |
| C.NO2 | D.N2 |
在酸性条件下,向含铬废水中加入FeSO4,可将有害的Cr2O72﹣转化为 Cr3+,然后再加入熟石灰调节溶液的pH,使Cr3+ 转化为Cr(OH)3沉淀而从废水中除去。下列说法正确的是
| A.FeSO4在反应中作氧化剂 |
| B.随着反应的进行,该废水的pH会减小 |
| C.若该反应转移0.6mol e﹣,则会有0.2mol Cr2O72﹣ 被还原 |
| D.除去废水中含铬元素离子的过程包括氧化还原反应和复分解反应 |
24 mL浓度为0.05 mo1/L的Na2SO3溶液恰好与20 mL浓度为0.02 mol/L的K2Cr2O7溶液完全反应。已知Na2SO3被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为 ( )
| A.+2 | B.+3 | C.+4 | D.+5 |
3Cu+ 8HNO3(稀) =3Cu(NO3)2+2NO↑+ 4H2O下列有关说法中不正确的是
| A.HNO3在反应中既表现氧化性也表现出酸性 |
| B.每生成22.4 L NO(标准状况)有3 mol电子转移 |
| C.HNO3作氧化剂,铜作还原剂,3 mol Cu还原8 mol的HNO3 |
| D.HNO3作氧化剂,铜作还原剂,3 mol Cu还原2 mol的HNO3 |
将和
的混合气体448
通过加热的三氧化二铬,充分反应后,再通过足量的水,最终收集到44.8
气体。原混合气体中
的体积可能是(假设氨全部被氧化;气体体积均已换算成标准状况)
| A. |
231.5
|
B. |
268.8
|
C. |
287.5
|
D. |
313.6
|
往100 mL氢离子浓度为1mol·L-1的硫酸和硝酸混合液中投入3.84 g铜粉,微热使反应充分完成后,生成NO气体448 mL(标准状况)。则反应前的混合液中含硫酸的物质的量为
| A.0.01mol | B.0.02 mol | C.0.03 mol | D.0.04 mol |
足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与3.36 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是
| A.60 mL | B.90 mL | C.120 mL | D.45 mL |
危化仓库中往往存有钠、钾、硫、白磷(P4)、硝酸铵和氰化钠(NaCN)等危险品。请回答下列问题:
(1)NH4NO3为爆炸物,在某温度下按下式进行分解:5NH4NO3 =4N2 ↑+ 2HNO3 + 9H2O
则被氧化和被还原的氮元素质量之比为_____________;
(2)硫酸铜溶液是白磷引起中毒的一种解毒剂:1lP4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4
若6molH3PO4生成,则被CuSO4氧化的P4的物质的量为______________mol;
(3)NaCN属于剧毒物质,有一种处理方法其原理为:CN-与S2O32-反应生成两种离子,一种与Fe3+可生成红色弱电解质,另一种与H+作用产生能使品红溶液腿色的刺激性气体,写出离子反应方程式:_________________________________。
葡萄酒常用Na2S2O5做抗氧化剂。
(1)1.90g Na2S2O5最多能还原 mLO2(标准状况)。
(2)0.5mol Na2S2O5溶解于水配成1L溶液,该溶液pH=4.5。溶液中部分微粒浓度随溶液酸碱性变化如图所示。
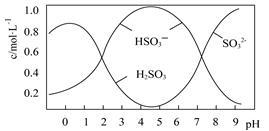
写出Na2S2O5溶解于水的化学方程式 ;当溶液pH小于1后,溶液中H2SO3的浓度变小,其原因可能是 。
已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7。把部分被空气氧化的该溶液pH调为10,向溶液中滴加BaCl2使SO42-沉淀完全[c(SO42-)≤1×10-5mol·L-1],此时溶液中c(SO32-)≤ mol·L-1。
(3)葡萄酒样品中抗氧化剂的残留量测定(已知:SO2+I2+2H2O=H2SO4+2HI):准确量取100.00mL葡萄酒样品,加酸蒸馏出抗氧化剂成分。取馏分于锥形瓶中,滴加少量淀粉溶液,用物质的量浓度为0.0225mol·L-1标准I2溶液滴定至终点,消耗标准I2溶液16.02mL。重复以上操作,消耗标准I2溶液15.98mL。计算葡萄酒样品中抗氧化剂的残留量 (单位:mg·L-1,以SO2计算,请给出计算过程。)
某氧化剂中,起氧化作用的是X2O72-离子,在溶液中0.2 mol该离子恰好能使0.6molSO32-离子完全氧化为SO42-,则X2O72-离子还原后的化合价为
| A.+1 | B.+2 | C.+3 | D.+4 |
有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数之比为2:3:3,向溶液中通入氯气,使溶液中Cl-和Br-的个数比为7:3(已知还原性I->Fe2+>Br->Cl-),则通入氯气的物质的量与溶液中剩余的Fe2+的物质的量之比为
| A.5:4 | B.4:5 | C.5:12 | D.12:5 |
酸性条件下20mL 0.5mol/L的KMnO4溶液可将25 mL 2 mol/L的FeSO4溶液中的Fe2+恰好完全氧化为Fe3+,则KMnO4被还原的产物是
| A.K2MnO4 | B.Mn2O3 | C.MnO2 | D.Mn2+ |