现有下列十种物质:①H2 ②铝 ③CuO ④CO2 ⑤H2SO4 ⑥Ba(OH)2 ⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨稀硝酸 ⑩Al2(SO4)3
(1)按物质的分类方法填写表格的空白处:
| 分类标准 |
|
氧化物 |
|
|
电解质 |
| 属于该类的物质 |
② |
|
⑧⑨ |
⑦ |
|
(2)上述十种物质中有两种物质之间可发生离子反应:H++OH- H2O,该离子反应对应的化学方程式为 。
H2O,该离子反应对应的化学方程式为 。
(3)⑩在水中的电离方程式为 ,17.1g⑩溶于水配成250mL溶液,SO42-的粒子数为 ,SO42-的物质的量浓度为 。
(4)少量的④通入⑥的溶液中反应的离子方程式为 。
(5)②与⑨发生反应的化学方程式为:Al + 4HNO3 = Al(NO3)3 + NO↑ + 2H2O,该反应的氧化剂是 (填化学式),还原剂与氧化剂的物质的量之比是 ,当有5.4g Al发生反应时,转移电子的物质的量为 。
该反应的离子方程式为 。
汽车尾气产生的NO2、CO等大气污染物,可以在催化剂的作用下转化为无毒物。其反应式可表示为:2NO2 +4CO=N2 +4CO2
①用双线法标出上述反应电子转移的方向和数目:
②该反应中氧化剂是 ,还原剂是 ,每有28g N2生成,反应中转移的电子为_____mol。
如图为实验室某浓盐酸试剂瓶的标签上的有关数据,试回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为___________。若用KMnO4。氧化上述HCl。其反应方程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(2)1molKMnO4完全反应,反应后溶液的体积为2L,则所得产物中Cl-的物质的量浓度为____________。
(3)8molHCI完全反应,产生的Cl2在标准状况下的体积为_____________。
已知实验室制氯气的化学方程式为:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O,其中
MnCl2+Cl2↑+2H2O,其中
(1) MnO2中Mn元素被_____________。(填“氧化”或“还原”)
(2) HCI中氯原子___________(填“得到”或“失去”)电子。
(3)反应中还原剂与氧化剂的物质的量之比为______________。
(4)标出此反应中电子转移情况:MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
实验室也可用反应2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O来快速制取氯气。
(1)请标出电子的转移方向和数目
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(2)若产生标准状况下Cl2 11.2L,则反应过程中转移的电子数为________ ,被氧化的还原剂
的物质的量为___________。
(3)需消耗36.5%的浓盐酸多少质量?
有一块锌片插入足量CuSO4溶液1L中,可以观察到锌片表面有黄色附着物析出,最后称量时锌片质量减轻了0.1g(假设溶溶液体变化忽略不计),求:
(1)(1)参加反应的还原剂的物质的量是 ;
(2)还原产物的物质的量是 ;
(3)生成ZnSO4的物质的量浓度是 ;
(4)溶液的质量 ;(填“增加”或“减少”)
(5)写出该反应的离子方程式 。
CuSO4溶液与K2C2O4溶液混合生成一种蓝色钾盐水合物KaCub(C2O4)c·nH2O。通过下述实验确定该晶体的组成。
步骤a:称取0.6720 g样品,放入锥形瓶,加入适量2mol·L-1稀硫酸,微热使样品溶解。再加入30 mL水加热,用0.2000mol·L-1 KMnO4溶液滴定至终点,消耗8.00 mL KMnO4溶液。有关反应:2MnO4-+5C2O42-+16H+=2Mn2++8H2O+10CO2↑
步骤b:接着将溶液充分加热。冷却后,调节pH并加入过量的KI固体,溶液变为棕色并产生白色沉淀CuI。用0.2500mol·L-1 Na2S2O3标准溶液滴定至终点,消耗8.00 mL Na2S2O3溶液。滴定时反应为:I2+2S2O32-=2I-+S4O62-
(1)步骤b中生成白色沉淀的离子方程式: 。
(2)步骤b中“将溶液充分加热”的目的是 。
(3)请完成下列确定样品组成的计算过程。
①计算样品中n (C2O42-)(写出计算过程)
②计算样品中n (Cu2+) (写出计算过程)
③根据 原理可求出n (K+),再依据 原理求得n (H2O)
④该样品晶体的化学式为
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。制备ClO2有下列两种方法:
方法一:2 NaClO3+4 HCl=2 ClO2↑+Cl2↑+2 NaCl+2 H2O
方法二:2 NaClO3+H2O2+H2SO4=2 ClO2↑+O2↑+2 Na2SO4+2 H2O
(1)方法一的离子方程式为 .
(2)方法二中被氧化的物质是 ,若反应中有0.1mol电子转移,则产生的ClO2气体在标准状况下的体积为 L.
(3)用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是 。
储氢纳米碳管的研制成功体现了科技的进步。用电弧法合成的纳米碳管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化汽化法提纯。其反应中的反应物和生成物有C、CO2、H2SO4、K2Cr2O7、K2SO4、Cr2(SO4)3、H2O七种物质。
(1)请用上述物质填空,并配平化学方程式:
(2)上述反应中氧化剂是(填化学式)_______________,被氧化的元素是(填元素符号)_____________。
(3)H2SO4在上述反应中表现出来的性质是(填选项编号)____________________。
A.氧化性 B.酸性 C.氧化性和酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为________升。
已知:氧化性:KMnO4>HNO3;Bi位于周期表中VA族,+3价较稳定,Bi2O3为碱性氧化物,Bi3+的溶液为无色。取一定量硝酸酸化的Mn(NO3)2溶液依次进行下列实验,现象记录如下:
① 向其中加入适量的NaBiO3,溶液变为紫红色。② 继续滴加适量H2O2,紫红色褪去,并有气泡产生。③ 再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
回答下列问题:
(1)写出实验①反应的离子方程式:______________________________________。
(2)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为____________________________。
(3)向反应③得到的溶液中通入SO2气体,看到的现象是____________________________。
(4)若实验②放出了336mL气体(标准状况),则反应①被氧化的Mn(NO3)2为________mol。
硝酸盐受热分解的产物与硝酸盐的组成以及受热的温度等因素有关。
Ⅰ.一定条件下硝酸铵受热分解的化学反应方程式为:NH4NO3→HNO3+N2 +H2O(未配平)
(1)该反应中发生还原反应的过程是_______→________。
(2)反应中被氧化与被还原的氮原子数之比为__________;现有1mol NH4NO3分解,生成的氧化产物的物质的量是 mol。
Ⅱ.硝酸铵受撞击或高温发生爆炸的化学反应方程式为:m NH4NO3→n O2+p N2+q H2O
(3)下列关于该方程式中化学计量数的说法正确的是_________(选填字母编号)。
a.m=1 b.n=2 c.p=3 d.q=4
(4)若反应过程中共转移3.01×1023个电子,则反应可产生气体的体积为_____(标准状况)。
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。
(1)工业上制备ClO2的反应原理常采用:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
① 浓盐酸在反应中显示出来的性质是_______(填序号)。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
② 若上述反应中产生0.1 mol ClO2,则转移电子的物质的量为_______mol。
(2)目前已开发出用电解法制取ClO2的新工艺。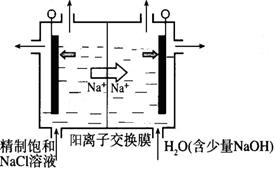
①上图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。写出阳极产生ClO2的电极反应式:__________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_________mol;用平衡移动原理解释阴极区pH增大的原因______________。
(3)ClO2对污水中Fe2+、Mn2+、S2—和CN-等有明显的去除效果。某工厂污水中含CN- a mg/L,现用ClO2将CN-氧化,只生成两种气体,其离子反应方程式为_______;处理100 m3这种污水,至少需要ClO2 _______ mol 。
在放电条件下,氮气与氧气可直接化合:N2+O2 2NO。该反应中,氧化剂是________(填化学式),若反应中消耗了1 mol N2,则转移_______mol电子。
2NO。该反应中,氧化剂是________(填化学式),若反应中消耗了1 mol N2,则转移_______mol电子。
将适量的XeO3投入30mL 0.1 mol/L Mn2+的水溶液中,刚好完全反应。此时转移电子_____________mol。将反应后的溶液稀释至90mL,所得溶液的pH=________。