[北京]2012-2013学年北京市西城区(北区)高一上学期期末考试化学试卷
下列溶液中,常温下可以用铁罐装运的是
| A.浓盐酸 | B.稀硝酸 | C.浓硫酸 | D.硫酸铜溶液 |
当光束通过下列分散系时,能观察到丁达尔效应的是
| A.盐酸 | B.硫酸铜溶液 | C.蔗糖溶液 | D.氢氧化铁胶体 |
下列物质与常用危险化学品的分类不对应的是
| A.NaOH——腐蚀品 | B.浓硫酸——易爆品 |
| C.Na——遇湿易燃物品 | D.KMnO4——氧化剂 |
下列变化中,需加入适当的氧化剂才能完成的是
| A.Fe→FeCl2 | B.CuO→Cu | C.HNO3→NO | D.SO3→H2SO4 |
下列物质分类中,前者包括后者的是
| A.化合物电解质 | B.溶液胶体 |
| C.氧化物化合物 | D.溶液分散系 |
氧化还原反应的实质是
| A.氧元素参加反应 | B.元素化合价变化 |
| C.电子的转移(得失或偏移) | D.原子重新组合 |
下列电离方程式正确的是
| A.CuCl2=Cu2++Cl2- | B.Ba(OH)2=Ba2++ |
| C.Al2(SO4)3=2Al3++3SO42- | D.HNO3=H++N5++3O2- |
下列叙述中,不正确的是
| A.氨可用作制冷剂 |
| B.硅可用于制光导纤维 |
| C.水玻璃可制备木材防火剂 |
| D.过氧化钠可用作潜水艇中氧气的来源 |
下列行为中,符合安全要求的是
| A.严禁在加油站附近燃放烟花爆竹 |
| B.金属钠意外着火时,立即用沾水的毛巾覆盖 |
| C.当有大量氯气泄漏时,人应沿顺风方向疏散 |
| D.将含有硫酸的废液倒入水池,用大量水冲入下水道 |
在某无色透明的酸性溶液中,能共存的离子组是
| A.Na+、K+、SO42-、HCO3- | B.Cu2+、K+、SO42-、NO3- |
| C.Na+、K+、Cl-、SO42- | D.Fe2+、K+、NO3-、Cl- |
下列离子方程式书写正确的是
| A.铁片插入稀硫酸中 2Fe+6H+=2Fe3++3H2↑ |
| B.氢氧化镁与稀硫酸反应 H++OH-=H2O |
| C.向硝酸银溶液中加盐酸 AgNO3+Cl-=AgCl↓+NO3- |
| D.用氢氧化铝治疗胃酸(HCl)过多 Al(OH)3+3H+=Al3++3H2O |
下列实验操作中,不正确的是
| A.过滤时,用玻璃棒引流 |
| B.蒸馏过程中,冷却水上口进,下口出 |
| C.实验室制备氢氧化亚铁时,滴加氢氧化钠溶液的胶头滴管伸入液面下 |
| D.稀释浓硫酸时,将浓硫酸沿烧杯壁慢慢地倒入水中,并用玻璃棒不断搅拌 |
可以用离子方程式H++OH-=H2O表示的化学反应是
①稀硫酸与氢氧化钡溶液反应 ②氢氧化钾溶液与稀硝酸反应
③稀盐酸与氢氧化铜反应 ④澄清石灰水与盐酸反应
| A.①③ | B.②④ | C.①②④ | D.②③④ |
下列叙述中,正确的是
| A.金属与酸反应一定放出氢气 |
| B.含金属元素的离子一定是阳离子 |
| C.电离生成H+的化合物不一定是酸 |
| D.金属离子被还原一定得到金属单质 |
下列叙述中,正确的是(NA代表阿伏加德罗常数)
| A.标准状况下,22.4 L水所含的水分子数为NA |
| B.1 mol·L-1FeCl3溶液中所含Cl-的数目为3NA |
| C.25℃,1.01×105Pa,14g氮气所含的氮原子数为NA |
| D.1 mol Na2SO4溶于水,所得溶液中Na+的数目为NA |
只用一种试剂,区别下列四种溶液Na2SO4、Al2(SO4)3、FeCl2、(NH4)2SO4,此试剂是
| A.稀盐酸 | B.BaCl2溶液 | C.AgNO3溶液 | D.NaOH浓溶液 |
下列关于Na2CO3和NaHCO3的叙述中,正确的是
| A.NaHCO3的俗称是苏打 |
| B.Na2CO3溶液显碱性,说明Na2CO3属于碱 |
| C.相同条件下,在水中碳酸钠的溶解度小于碳酸氢钠的溶解度 |
| D.向Na2CO3和NaHCO3固体中分别滴加等浓度的盐酸,后者反应速率快 |
向FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是(已知氧化性:Fe3+>Cu2+)
| A.溶液中一定含Cu2+ | B.溶液中一定含有Fe2+ |
| C.加入KSCN溶液一定不变红色 | D.剩余固体中一定含铜 |
用下图所示装置及药品进行相应实验,能达到实验目的的是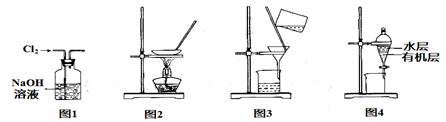
| A.图l除去Cl2中含有的少量HCl |
| B.图2蒸干NH4Cl饱和溶液制备NH4Cl晶体 |
| C.图3除去Fe(OH)3胶体中的FeCl3 |
| D.图4分离CCl4萃取碘水后的有机层和水层 |
下列实验现象和结论相符的是
| |
操作及现象 |
结论 |
| A |
某溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色无味气体 |
溶液中一定含有CO32- |
| B |
某溶液中加入硝酸银,产生白色沉淀 |
溶液中一定含有Cl- |
| C |
用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色 |
溶液中有Na+,无K+ |
| D |
向某溶液中先加几滴KSCN溶液,无明显现象,再滴氯水,溶液变红 |
溶液中一定含有Fe2+ |
NH3具有一定的还原性,常温下可被Cl2氧化为N2。在一密闭容器中,充入一定量NH3和Cl2充分反应后,恢复到原状态所得气体产物体积最小,则反应前Cl2和NH3的体积比是
| A.3:2 | B.3:5 | C.3:8 | D.无法计算 |
在放电条件下,氮气与氧气可直接化合:N2+O2 2NO。该反应中,氧化剂是________(填化学式),若反应中消耗了1 mol N2,则转移_______mol电子。
2NO。该反应中,氧化剂是________(填化学式),若反应中消耗了1 mol N2,则转移_______mol电子。
钠、铝和铁是三种重要的金属。请回答:
(1)钠原子的结构示意图是________________。
(2)三种金属中,既能与盐酸又能与氢氧化钠溶液反应的是_________(填化学式),写出其与氢氧化钠溶液反应的离子方程式________。
(3)三种金属在一定条件下均能与水发生反应。其中,铁与水蒸气反应的化学方程式是_____________________。取一小块金属钠放在滴有酚酞的水中,实验现象正确的是________(填选项)。
①钠浮在水面迅速反应 ②钠沉在水底迅速反应 ③钠熔成小球并快速游动
④反应中可以听到嘶嘶的响声 ⑤反应后的溶液变为红色
a. ①④⑤ b. ②③④⑤ c. ①③④⑤
(4)铁、铝是常用的金属材料,在空气中铝比铁更耐腐蚀。对此合理的解释是______ __________________________。
NaCl在生活、生产和科研中都有广泛的用途。
I. 从海水中提取的粗盐含有Ca2+、Mg2+、SO4-等离子,为制备精盐可使用以下四种试剂:①Na2CO3溶液 ②BaCl2溶液 ③NaOH溶液 ④盐酸(用于沉淀的试剂均稍过量)。
(1)加入试剂的合理顺序是________(填选项)。
a. ①②③④ b. ③①②④ c. ②①③④ d. ③②①④
(2)加入过量Na2CO3溶液的作用是________________。
II. 实验室要配制100 mL 0.2 mol·L-1 NaCl溶液。
(1)用托盘天平称氯化钠固体的质量是________g。
(2)配制溶液需要使用的主要玻璃仪器有烧杯、玻璃棒、胶头滴管和________。
(3)下列操作中,可能造成所配制溶液的浓度偏低的是________(填选项)。
a. 没有洗涤烧杯和玻璃棒 b. 定容时,俯视刻度线
c. 洗涤后的容量瓶中残留少量蒸馏水
某化学小组同学利用以下药品及装置制取氨气并研究其性质(部分仪器已略去)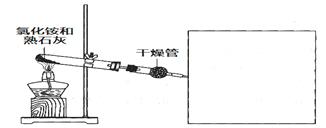
请回答:
(1)制备氨气的化学方程式是________________。
(2)干燥氨气可选用的试剂是________(填选项)。
a. 浓硫酸 b. 碱石灰 c. 氢氧化钠溶液
(3)在方框内绘制用小试管收集氨气的装置图。
(4)在实验室中检验氨气可选用________石蕊试纸。也可用玻璃棒蘸取浓盐酸,若观察到________________(填现象),即可证明,该反应的化学方程式是
________________________________________________________________________
某同学用如图所示的装置进行铜与浓硫酸反应的实验。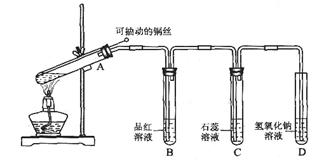
请回答:
(1)铜与浓硫酸反应的化学方程式是________________________
(2)实验过程中,观察到品红溶液________________,石蕊溶液________________,说明SO2________(填选项)。
a. 有氧化性 b. 有还原性 c. 有漂白性 d. 水溶液显酸性
(3)为进一步确认产生的气体是二氧化硫气体,还应补充的操作是________________
(4)结合离子方程式说明试管D中氢氧化钠溶液的作用是______________________
(5)把试管A中的液体冷却后慢慢倒入盛有水的烧杯里,观察到溶液呈________色,说明铜元素被氧化生成了________离子。
经精选后的铝土矿A(主要成份为Al2O3,含有一定量的Fe2O3、SiO2杂质),可用A来制备电解铝原料——氧化铝,某课外小组同学模拟该过程,设计了如下方案: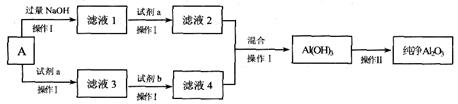
请回答:
(1)A中Al2O3与过量氢氧化钠溶液反应的化学方程式是________________
(2)操作I的名称是________________。
(3)下列说法中正确的是________(填选项)。
a 操作Ⅱ是灼烧 b. 滤液3所含阳离子是Fe3+、Al3+
c. 试剂b可用氢氧化钠 d. 为保证转化完全,所加试剂a和试剂b均应过量
(4)写出滤液2、4混合后生成Al(OH)3的离子方程式是______________________ __
将7.8 g过氧化钠与足量的水充分反应,所得溶液的体积为100 mL。试计算:(1)生成氧气的体积(标准状况)。(2)反应后所得溶液中溶质的物质的量浓度。(上述计算均要求写出计算过程)
有一无色透明溶液,欲确定是否含有下列离子:Na+、Mg2+、Ba2+、NO3-、SO42-、Cl-、CO32-,实验如下:
| 实验步骤 |
实验现象 |
| ①取少量原溶液,加入几滴酚酞试液 |
溶液变成红色 |
| ②取少量原溶液加热浓缩,加入Cu片和一定浓度的H2SO4 |
有无色气体产生,该气体遇空气变成红棕色 |
| ③取少量原溶液,加入BaCl2溶液 |
有白色沉淀生成 |
| ④取③中上层清液,先加入稀硝酸,再加入AgNO3溶液 |
有白色沉淀生成 |
由此判断:
(1)溶液中肯定存在的离子是________________________,肯定不存在的离子是________________,可能存在的离子是________________。
(2)实验②中生成无色气体的离子方程式是________________________________。
(3)为进一步确定可能存在的阴离子,应该补充的实验设计是__________________。
某课外小组同学用下图所示装置进行实验(夹持装置已省略)。
(1)用该装置制备NO2并研究其性质。
①收集一试管NO2,取下试管B倒立在水中,观察到的现象是________________。
②该反应的化学方程式是________________________________。
③C中NaOH溶液吸收NO2,生成两种盐,且被氧 化与被还原的NO2的物质的量之比是1:1,请写出该反应的离子方程式________________________________。
(2)该装置也可用于制备Cl2并研究其性质。
①若A中固体为漂白粉,滴入浓盐酸,则A中发生反应的化学方程式是___________。
②在B中放一小块湿润的淀粉碘化钾试纸,可观察到试纸变蓝,请结合离子方程式解释原因________________________________________。
③硫代硫酸钠(Na2S2O3)可替代NaOH溶液吸收氯气,已知25.0mL 0.1 mol·L-1的Na2S2O3溶液恰好把标准状况下224 mL Cl2完全转化为Cl-时,S2O32-转化成_____(填选项)。
a. S2- b. S c. SO32- d. SO42-




 粤公网安备 44130202000953号
粤公网安备 44130202000953号