金属钒(V)在材料科学上有重要作用,被称为“合金的维生素”。以下是测定矿石中钒的含量的两个反应:
(1)用稀硫酸溶解五氧化二钒,得到(VO2)2SO4溶液。写出该反应的化学方程式
____________________________________________________________;
该反应______(选填“是”或“不是”)氧化还原反应。
(2)用已知浓度的硫酸酸化的H2C2O4溶液,滴定(VO2)2SO4溶液,完成下列离子方程式,方框内填数字,短线上填写物质的化学式或离子符号。
VO2+ + H2C2O4 + ______ → VO2+ + CO2 + ______
(3)当收集到标准状况下气体112毫升时,电子转移的数目为
(4)甲同学提出:上述反应能否用盐酸酸化?乙同学认为:要回答这个问题还得知道
A.VO2+ 和HCl氧化性相对强弱 B.VO2+ 和Cl2氧化性相对强弱 C.上述均不正确.
(1)向MnSO4和硫酸的混合溶液里加入K2S2O8(过二硫酸钾),溶液中会发生如下反应:Mn2++ S2O82-+H2O→MnO4-+SO42一十H+该反应常用于检验Mn2+的存在。其特征现象是 。若反应中有0.1 mol还原剂参加反应,则消耗氧化剂的物质的量为 mol。
(2)若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的生成物还有 。
(3)将NaBiO3固体(黄色微溶)加入到MnSO3和H2SO4的混合溶液里加热,固体溶解变为澄清溶液,发生如下反应: NaBiO3+ MnSO4+ H2S04→ Na2S04+ Bi2(SO4)3+ NaMnO4+ H2O。
①配平上述反应的化学方程式;
②上述反应中还原产物是 。
③用单线桥表示该氧化还原反应 。
(4)S2O82-在一定条件下,可转变为S2O32-,写出往K2S2O3中滴加稀硫酸的离子方程式: 。
1.52g铜镁合金完全溶解于50mL密度为1.40g·mL-1、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol·L-1NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀。
(1)该合金中铜与镁的物质的量之比是 。
(2)NO2和N2O4的混合气体中,NO2的体积分数是 。
(3)得到2.54 g沉淀时,加入NaOH溶液的体积是 mL。
钒具有众多优异的性能,用途十分广泛,有金属“维生素”之称。
完成下列填空:
(1)将废钒催化剂(主要成分V2O5)与稀硫酸、亚硫酸钾溶液混合,充分反应,所得溶液显酸性、含VO2+、K+、SO42–等。写出该反应的化学方程式 。
(2)向上述所得溶液中加入KClO3溶液,充分反应后,溶液中新增加了VO2+、Cl–。写出并配平该反应的离子方程式,并标出电子转移的数目和方向_____________________。
(3)在20.00mL的0.1mol/L VO2+溶液中,加入 0.195g锌粉,恰好完成反应,则还原产物可能是__________________。
a.V b.V2+ c.VO2+ d.VO2+
(4)已知V2O5能和盐酸反应生成氯气和VO2+。请再写一个离子反应方程式,说明还原性:SO32–>Cl–>VO2+____________。
为了测定草酸晶体(H2C2O4·xH2O)中的x值,进行如下实验
(1)称取Wg草酸晶体,配成100.00mL溶液
(2)取25.00mL所配溶液于锥形瓶内,加入适量稀H2SO4后,用浓度为amol/L的KMnO4溶液滴定至KMnO4不再褪色为止,所发生的反应为: 2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。
试回答:
①实验中,需要的仪器有(填序号) ,还缺少的仪器有(填名称)
A托盘天平(带砝码、镊子) B滴定管 C 100mL的量筒 D、100mL的容量瓶
E、烧杯 F、漏斗 G、锥形瓶 H、玻璃棒 I、药匙 J、烧瓶
②实验中,标准KMnO4溶液应装在 式滴定管中,因为
③若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴至终点,则所测得的x的值会 (填偏大、偏小、无影响)。
④在滴定过程中若用去amol/L的KMnO4溶液VmL,则所配制的草酸溶液的物质的量浓度为 mol/L,由此,x= 。
⑤若滴定终点读数时俯视刻度,则计算的x值会 (填偏大、偏小、无影响)。
某氮肥厂氨氮废水中氮元素多以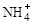 和NH3·H2O的形式存在,该废水的处理流程如下:
和NH3·H2O的形式存在,该废水的处理流程如下: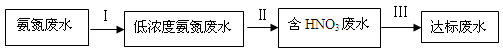
(1)过程Ⅰ:加NaOH溶液,调节pH至9后,升温至30 ℃,通空气将氨赶出并回收。用离子方程式表示加NaOH溶液的作用: 。
(2)过程Ⅱ:在微生物作用的条件下,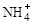 经过两步反应被氧化成
经过两步反应被氧化成 。其中第一步反应的能量变化示意图如下:
。其中第一步反应的能量变化示意图如下: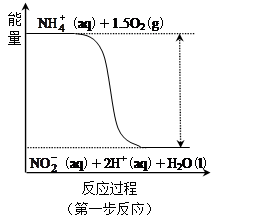
第一步反应是 反应(选填“放热”或“吸热”),判断依据是
(3)过程Ⅲ:一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗32 g CH3OH转移6 mol电子,则参加反应的还原剂和氧化剂的物质的量之比是 。
已知KCl、K2Cr2O7、CrCl3、Cl2、HCl在溶液中可以形成一个氧化还原反应体系。
(1)已知反应中有水生成,则反应物分别是 和 (填化学式),当电子转移数为6mol时,化学方程式中水的化学计量数是 。
(2)反应过程中,发生氧化反应的物质是__________,被还原的元素是_________。
(3)当反应体系中Cl2的体积是224mL(标准状况)时,反应过程中转移电子______ mol。
(实验班做,12分)
I. 臭氧层是地球生命的保护神,臭氧比氧气气具有更强的氧化性。实验室可将氧气通过高温放电管来制取臭氧:3O2  2O3 。
2O3 。
(1)若在上述反应中有40%的氧气转化为臭氧,所得混合气体的平均摩尔质量为__________g/mol。(保留一位小数)
(2)将9L氧气通过高压放电管后,恢复到原状况,得到气体6.5L,其中臭氧为________L。
(3)实验室将氧气和臭氧的混合气体1.568L(标准状况)通入盛有20.0g铜粉的反应器中,充分反应后,粉末质量变为23.2g。则原混合气体中臭氧的体积分数为________。(保留一位小数)。
II.将1.28g铜片投入足量硝酸溶液中充分反应,铜片溶解,溶液变蓝,同时收集到一定量混合气体。经测定,该混合气体中含有N2O,NO2,N2O4,NO四种成分,将该混合气体与足量空气混合,同时通入足量NaOH溶液中,氮氧化物完全被吸收,生成NaNO3。则空气中参与反应的O2的物质的量为__________。
(8分)
某一反应体系中,有反应物和生成物共五种物质,这五种物质是:Cl2、KMnO4、MnCl2、H2O、HCl(浓)、KCl,其中Cl2、H2O均为生成物。
(1)该反应中的氧化剂是 ,氧化产物为 。
(2)该反应中,氧化产物与还原产物的物质的量之比为 。
(3)若产生的气体在标准状况下体积为2.24L,则反应过程中转移电子的数目为 NA(NA表示阿伏伽德罗常数的值),发生反应的KMnO4的质量为 g。
(4)购买的浓盐酸(密度为1.19g/cm3)在工业上是用HCl气体(标准状况)与H2O按体积比500:1配制成的,则该盐酸的物质的量浓度是 mol/L(结果保留两位小数)。
完成下列各题:
(1)在18.6g Fe和Zn合金中加入200mL某浓度的稀硫酸恰好完全反应,生成0.3mol H2。则原合金中有 mol Fe,稀硫酸的物质的量浓度为 mol/L。
(2)已知19.2gCu与过量的200ml 5mol/L稀硝酸充分反应,反应方程式如下,请计算(忽略反应前后溶液体积的变化)。
3Cu+8HNO3 加热 3Cu(NO3)2+2NO↑+4H2O
转移电子的个数为 (用NA表示阿伏加德罗常数);标准状况下,产生NO气体的体积为 。
反应后,H+的物质的量浓度为 ,NO3-的物质的量浓度为 。
某化学反应的反应物和产物如下:
(1)Al+NaNO3+H2O →Al(OH)3+N2↑+NaAlO2
① 该反应的氧化剂是 。
② 该反应的氧化产物是 。
③ 反应过程中转移5mole-,生成标准状况下N2的体积为 L。
(2)对于反应:K2Cr2O7 + HCl → KCl + CrCl3 + Cl2↑ + H2O,回答下列问题:
①配平方程式,并用单线桥表示此反应转移的电子数目及方向。
____K2Cr2O7 + ____HCl ===" ____KCl" +____ CrCl3 + ____Cl2↑ + ____H2O
② 若反应中,发生氧化反应的HCl为1.2 mol,则被还原的K2Cr2O7 物质的量为___________mol。
(10分)为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程可用下列化学方程式表示: ① 3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
② Na2FeO2+ NaNO2+ H2O → Na2Fe2O4+ NH3↑+ NaOH
③ Na2FeO2+Na2Fe2O4+2H2O Fe3O4+4NaOH
Fe3O4+4NaOH
(1)配平化学方程式②。
(2)上述反应①中还原剂为 ,若有1mol Na2FeO2生成,则反应中有 mol电子转移。
(3)关于形成“发蓝”的过程,下列说法正确的是 。
| A.该生产过程不会产生污染 | B.反应③生成的四氧化三铁具有抗腐蚀作用 |
| C.反应①②③均是氧化还原反应 | D.反应①②中的氧化剂均为NaNO2 |
(4)当NaOH溶液浓度过大,“发蓝”的厚度会变小,其原因是
。
已知反应:3NO2+H2O==2HNO3+NO,回答下列问题:
(1)该反应的离子方程式为 。
(2)氧化剂与还原剂的质量比为 ,氧化产物与还原产物的物质的量之比为 。
(3)在标准状况下,3.36L NO2与H2O完全反应转移的电子数目为 。
(4)写出HNO3与石灰水反应的离子方程式 。
将0.08mol KMnO4固体(质量为12.64g)加热一段时间后,收集到a molO2;向反应后残留的固体中加入足量的浓盐酸,又收集到b molCl2,此时Mn元素全部以Mn2+的形式存在于溶液中。
(1)请配平下列方程式:
KMnO4+ HCl - KCl+ MnCl2+ Cl2↑+ H2O
(2)上式反应中的还原剂是 ,当还原剂失去1mol电子时,氧化产物的物质的量为 。
(3)a +b的最大值为 ,a +b最小值为 。
(4)当 a +b =0.18时,残留固体的质量为 。