有下列三个反应:
①Cl2+FeI2=FeCl2+I2;②2Fe2++Br2=2Fe3++2Br-;③CO2O3+6HCl=2COCl2+Cl2↑+3H2O下列说法正确的是
| A.① ② ③中的氧化产物分别是I2、Fe3+、COCl2 |
| B.根据以上方程式可以得到氧化性Cl2>Fe3+>CO2O3 |
| C.可以推理得到Cl2+FeBr2=FeCl2+Br2 |
| D.在③反应中当1mol CO2O3参加反应时,2mol HCl被氧化 |
现有24 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与20 mL某浓度的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,元素Cr在还原产物中的化合价为+3价,则K2Cr2O7溶液的浓度为( )
| A.0.01 mol·L-1 | B.0.02 mol·L-1 | C.0.03 mol·L-1 | D.0.04 mol·L-1 |
溶液中有0.2mol XO4—,加入0.3mol Na2SO3恰好反应,已知Na2SO3被氧化成Na2SO4,则还原产物中X的化合价为
| A.0 | B.+1 | C.+3 | D.+4 |
某溶液中含有1.2×10-3 mol XO3-,恰好能氧化30mL 0.1mol/LNa2SO3溶液(形成Na2SO4溶液),则还原产物中元素X的化合价是
| A.0 | B.- 2 | C.+3 | D.+2 |
在KClO3+6HCl==KCl+3Cl2↑+3H2O中,被氧化与被还原的氯原子个数之比为
| A.1∶6 | B.6∶1 | C.1∶5 | D.5∶1 |
已知RxO42-+MnO4-+H+→RO2+Mn2++H2O变化过程中,0.2molRxO42-参加反应,共转移0.4mol电子,则x为()
| A.2 | B.3 | C.4 | D.5 |
已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且 的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是
的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是
A.若某温度下,反应后 =11,则溶液中 =11,则溶液中 = = |
B.参加反应的氯气的物质的量等于 a mol a mol |
C.改变温度,产物中KClO3的最大理论产量为 a mol a mol |
D.改变温度,反应中转移电子的物质的量ne的范围: a mol≤ne≤ a mol≤ne≤ a mol a mol |
R2O8n-离子在一定条件下可把Mn2+氧化为MnO4-,若反应后R2O8n-离子变RO42-离子, 又知反应中氧化剂与还原剂的物质的量之比为5:2,则n值是
| A.4 | B.3 | C.2 | D.1 |
离子M2O7X-与S2-能在酸性溶液中发生如下反应:aM2O7X- +3S2- +cH+==2M3+ +eS+f H2O,则M2O7X-中M的化合价为 ( )
| A.+4 | B.+5 | C.+6 | D.+7 |
向VmLFeBr2溶液中缓慢通入amolCl2,结果溶液中有50%的Br-被氧化为溴单质,则原FeBr2溶液的物质的量浓度为
A.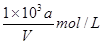 |
B.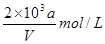 |
C.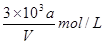 |
D.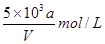 |
浓度为0.05 mol·L-1的Na2SO3溶液24 mL恰好能被20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液氧化为Na2SO4,则K2Cr2O7被还原后得到的产物中Cr元素的化合价为( )
| A.+5 | B.+4 | C.+3 | D.+2 |
向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2。在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是 ( )
| A.Cu与Cu2O 的物质的量之比为2:1 |
| B.硝酸的物质的量浓度为2.6mol/L |
| C.产生的NO在标准状况下的体积为4.48L |
| D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol |
含有1mol HNO3的稀硝酸分别与不同质量的铁粉反应,所得氧化产物a、b与铁粉物质的量关系如图所示。下列有关判断正确的是
| A.a是Fe(NO3)2 |
| B.n1 = 0.375 |
| C.p = 0.20 |
| D.n2 = 0.30 |
实验室将NaClO3和Na2SO3按物质的量之比为2∶1倒入烧瓶中,同时滴入适量稀H2SO4,并用水浴加热,产生棕黄色的气体X,反应后测得NaClO3和Na2SO3恰好完全反应,则X为
| A.Cl2 | B.Cl2O | C.ClO2 | D.Cl2O3 |