向VmLFeBr2溶液中缓慢通入amolCl2,结果溶液中有50%的Br-被氧化为溴单质,则原FeBr2溶液的物质的量浓度为
A.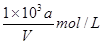 |
B.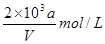 |
C.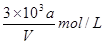 |
D.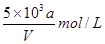 |
向100mL由等物质的量的FeBr2和FeI2配成的混合溶液中,缓慢通入氯气3.36L(标准状况),反应完全后,溶液中有一半的 Fe2+被氧化成Fe3+,则原混合液中FeI2的物质的量溶度为( )
| A.0.5 moL·L-1 | B.1.0 moL ·L-1 | C.1.2 moL ·L-1 | D.1.5 moL·L-1 |
浓度为0.05 mol·L-1的Na2SO3溶液24 mL恰好能被20 mL浓度为0.02 mol·L-1的K2Cr2O7溶液氧化为Na2SO4,则K2Cr2O7被还原后得到的产物中Cr元素的化合价为( )
| A.+5 | B.+4 | C.+3 | D.+2 |
在反应 3S+6KOH=K2SO3+2K2S+3H2O中,还原剂和氧化剂的物质的量为: ( )
| A.1 :1 | B.2 :1 | C.1 :2 | D.3 :2 |
一定条件下硝酸铵受热分解的化学反应方程式为:5NH4NO3 = 2HNO3 + 4N2 + 9H2O,在反应中被还原与被氧化的氮原子数之比为
| A.5:3 | B.4:5 | C.5:4 | D.3:5 |
工业上制取金刚砂的化学方程式如下:SiO2+3C=SiC+2CO↑。在这个氧化还原反应中,氧化剂和还原剂的物质的量之比为
| A.1︰2 | B.2︰1 | C.5︰3 | D.3︰5 |
向27.2gCu和Cu2O的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成NO 和Cu(NO3)2。在所得溶液中加入1.0mol/L 的NaOH溶液1.0L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2g。下列有关说法不正确的是 ( )
| A.Cu与Cu2O 的物质的量之比为2:1 |
| B.硝酸的物质的量浓度为2.6mol/L |
| C.产生的NO在标准状况下的体积为4.48L |
| D.Cu、Cu2O与硝酸反应后剩余HNO3为0.2mol |
现将1mo1Cu2S与144g FeO投入到足量稀硝酸溶液中,充分反应得到Fe(NO3)3、Cu(NO3)2、CuSO4的混合溶液,并产生NO气体。则最终反应所得NO物质的量为
| A.4 mo1 | B.5 mo1 | C.6 mo1 | D.7 mo1 |
已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如下图所示,下列说法中不正确的是( )

| A.图中AB段的氧化剂为K2Cr2O7 |
| B.图中BC段发生的反应为2Fe3++2I-=2Fe2++I2 |
| C.开始加入的K2Cr2O7为0.25mol |
| D.开始加入的K2Cr2O7与FeSO4的物质的量比为1:3 |
已知RxO42-+MnO4-+H+→RO2+Mn2++H2O变化过程中,0.2molRxO42-参加反应,共转移0.4mol电子,则x为()
| A.2 | B.3 | C.4 | D.5 |
等物质的量的下列化合物与足量浓盐酸反应,得到氯气物质的量最多的是
己知:MnO4-+H++Cl-→Mn2++C12↑+H2O(未配平)
C1O3-+H++Cl-→C12↑+H2O(末配平)
ClO-+H++Cl-→C12↑+H2O(未配平)
| A.KC1O3 | B.KMnO4 | C.MnO2 | D.Ca(C1O)2 |
若NA表示阿伏伽德罗常数,下列说法正确的是
| A.0.lmol氯气与铁反应,转移0.2NA电子 |
| B.0.lmol过氧化钠与水反应,转移0.2NA电子 |
| C.0.lmol铁与高温水蒸汽反应,转移0.3NA电子 |
| D.0.lmol二氧化锰与足量浓盐酸反应,有0.4NACl-被氧化 |
心脏起搏器一般是给心跳缓慢的病人使用。某种类型的心脏起搏器工作时发生下列反应:4Li+2SOC12=4LiC1+S+SO2,下列有关判断正确的是
| A.还原剂只有锂 |
| B.SOC12中每个原子都达到8电子稳定结构 |
| C.氧化产物包括LiCl和SO2 |
| D.生成1. 12 LSO2时,反应转移电子为0.2 mol |