将一定质量的镁、铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3mol/LNaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是
| A.加入合金的质量可能为9.6g |
| B.沉淀完全时消耗NaOH溶液体积为150mL |
| C.参加反应的硝酸的物质的量为0.4mol |
| D.溶解合金时产生NO气体体积0.224L |
取19.2g铜跟少量的浓硝酸反应,铜全部溶解后,收集到NO2、NO混合气体的体积11.2L(标准状况),反应消耗硝酸的物质的量是
| A.0.5mol | B.0.8mol | C.1.1mol | D.1.2mol |
Na2FeO4是一种高效多功能水处理剂,一种制备Na2FeO4的方法可用化学方程式表示为:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑,对此反应说法不正确的是
| A.Na2O2在反应中既作氧化剂又作还原剂 |
| B.O2是氧化产物 |
| C.Na2FeO4既是氧化产物又是还原产物 |
| D.2 mol FeSO4发生反应时,共有12 mol电子转移 |
高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,其与水反应的化学方程式是:4K2FeO4+10H2O=4Fe(OH)3(胶体)+3O2↑+8KOH 工业上先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入一定量的KOH就可制得高铁酸钾。制备高铁酸钠的两种方法的主要反应原理如下:
湿法制备:2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O
干法制备:2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
下列有关说法中错误的是
| A.高铁酸钾处理水时,高铁酸钾发生还原反应 |
| B.湿法中每生成1mol Na2FeO4共转移3mol电子 |
| C.干法中每生成1mol Na2FeO4共转移4mol电子 |
| D.K2FeO4处理水时,不仅能杀菌,并使悬浮杂质沉降 |
12ml0.1mol/L的亚硫酸(H2SO4)溶液,恰好跟20ml浓度为0.02mol/L的重铬酸钾(K2Cr2O7)溶液完全反应,则元素铬(Cr)在还原产物中的化合价是
| A.+1 | B.+2 | C.+3 | D.+6 |
运动会上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白烟。撞击时发生反应的化学方程式为:5KClO3+6P===3P2O5+5KCl,则下列有关叙述错误的是
| A.上述反应中Cl的化合价由+5价变为-1价 |
| B.P2O5是P被还原后所得的产物 |
| C.该反应被还原与被氧化物质的物质的量之比为5∶6 |
| D.上述反应中消耗3 mol P时,转移电子的物质的量为15 mol |
将9.60×10-4 mol 的XO4-在溶液中还原到较低价态,需用24 mL 0.100 mol/L 的H2O2溶液,则X元素的化合价变为
| A.+1 | B.+2 | C.+3 | D.+4 |
在100mLHNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6mol/L,向该溶液中加入足量的铜粉加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大值为:
| A.0.225 mol/L | B.0.30 mol/L |
| C.0.36 mol/L | D.0.45 mol/L |
活性氧化锌用作橡胶硫化的活性剂、补强剂。以氧化锌粗品为原料制备活性氧化锌的生产工艺流程如下:
一些阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Cu(OH)2 |
Zn(OH)2 |
Fe(OH)2 |
| pH |
3.2 |
6.7 |
8.0 |
9.7 |
(1)“溶解”后得到的酸性溶液中含有Zn2+、SO42-,另含有Fe2+、Cu2+等杂质。先加入__________(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2。经检测溶液中Fe2+的浓度为0.009 mol·L-1,则每升溶液中至少应加入________mol KMnO4。
(2)杂质Cu2+可利用置换反应除去,应选择的试剂是____________________________。
(3)“沉淀”得到ZnCO3·2Zn(OH)2·H2O,“煅烧”在450~500 ℃下进行,“煅烧”反应的化学方程式为___________________________________________________。
卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。下列对于过氧化钙(CaO2)的叙述错误的是
| A.CaO2具有氧化性,对面粉可能具有增白作用 |
| B.CaO2中阴阳离子的个数比为1:1 |
| C.CaO2和水反应时,每产生1 mol O2转移电子4 mol |
| D.CaO2和CO2反应的化学方程式为:2CaO2 +2CO2 =2CaCO3+O2 |
化学实验的微型化可有效地减少污染,实现化学实验绿色化的要求。某学生按下列操作做一个实验:在一块下衬白纸的玻璃片的不同位置分别滴加浓度为0.1 mol/L的KBr、KI(含淀粉溶液)、NaOH(含酚酞)、FeCl2(含KSCN)溶液各1滴,每种液滴彼此分开,围成半径小于表面皿的圆形(如下图所示),在圆心处放置2粒芝麻粒大小的KMnO4晶体,向KMnO4晶体滴加一滴浓盐酸,再立即将表面皿盖好。(e处反应的化学方程式为:2KMnO4+16HCl===2MnCl2+5Cl2↑+8H2O)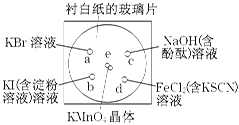
(1)e处反应中被氧化的HCl与参加反应的HCl的物质的量之比为 。
(2)b处的实验现象为___________________________________。
(3)c处反应的化学方程式为_____________________________________,标准状况下,当有0.224 L Cl2被NaOH溶液吸收后,转移电子的物质的量为 mol。
(4)通过该实验比较Cl2、FeCl3、KMnO4三种物质氧化性由强到弱的顺序是 。
(8分)实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。
MnCl2+Cl2↑+2H2O。取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。
请回答下列问题:
(1)写出该反应的离子反应方程式_____________________________________。
(2)参加反应的二氧化锰的质量为____________。
(3)反应中被氧化的HCl的物质的量为 ____________。
(4)实验室备用的浓盐酸质量分数为36.5%,密度为1.19g·cm-3,为使用方便,请计算出该浓盐酸
的物质的量浓度______________。
氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过反应:
Al2O3+N2+3C 2AlN+3CO合成。下列叙述正确的是
2AlN+3CO合成。下列叙述正确的是
| A.上述反应中,N2是还原剂,Al2O3是氧化剂 |
| B.AlN中氮的化合价为+3 |
| C.上述反应中,每生成1 mol AlN需转移3 mol电子 |
| D.AlN的摩尔质量为41 g |
(10分)将5.6 g Fe加入到100 mL的稀硫酸中溶液中,恰好完全反应。
(1)写出该反应的化学方程式,并标出电子转移方向和数目。
(2)试求生成气体在标准状况下的体积和稀硫酸的物质的量浓度。
(3)计算反应中转移的电子数目。