关于氢键,下列说法正确的是( )
| A.甲硫醇(CH3SH)比甲醇的熔点低的原因是甲醇分子间易形成氢键 |
| B.氯化钠易溶于水是因为形成了氢键 |
| C.氨易液化与氨分子间存在氢键无关 |
| D.H2O是一种非常稳定的化合物,这是由于氢键所致 |
下列叙述正确的是
| A.分子晶体中都存在共价键 |
| B.F2、C12、Br2、I2的熔沸点逐渐升高与分子间作用力有关 |
| C.含有极性键的化合物分子一定不含非极性键 |
| D.只要是离子化合物,其熔点一定比共价化合物的熔点高 |
下列说法正确的是( )
| A.原子最外层电子数为2的元素一定处于周期表ⅡA族 |
| B.主族元素X、Y能形成XY2型化合物,则X与Y 的原子序数之差可能为2或5 |
| C.离子化合物中不可能存在共价键 |
| D.金属元素与非金属元素形成的化合物一定是离子化合物 |
下列说法正确的是 ( )
| A.能与酸反应的氧化物,一定是碱性氧化物 |
| B.CC3N4晶体中,C—N键的键长比金刚石中的C-C键的键长要长 |
| C.分子晶体中分子间作用力越大,其分子越稳定 |
| D.分子晶体溶于水时,有些分子中的化学键被破坏,有些分子中的化学键不被破坏 |
下列性质中,可以证明某化合物中一定存在离子键的是 ( )
| A.可溶于水 | B.具有较高的熔点 |
| C.水溶液一定能够导电 | D.熔融状态能够导电 |
下列说法正确的是()
| A. |
原子晶体中只存在非极性共价键 |
| B. |
稀有气体形成的晶体属于分子晶体 |
| C. |
干冰升华时,分子内共价键会发生断裂 |
| D. |
金属元素和非金属元素形成的化合物一定是离子化合物 |
下列有关化学键与晶体结构说法正确的是
| A. | 两种元素组成的分子中一定只有极性键 |
| B. | 离子化合物的熔点一定比共价化合物的高 |
| C. | 非金属元素组成的化合物一定是共价化合物 |
| D. | 含有阴离子的化合物一定含有阳离子 |
某共价化合物分子中含有C.N、O、H四种元素,且以nC.nN、nO分别表示C.N和O的原子数目,则H原子数目最多为 ( )
A.2nO+2 B.2nC+nN C.2(nC+nN) D.2nC+nN+2
有关晶体的下列说法中正确的是( )
A.分子晶体中分子间作用力越大,分子越稳定
B.离子晶体中肯定不含非极性共价键
C.离子晶体在熔化时,离子键被破坏,而分子晶体熔化时,化学键不被破坏
D.两种元素组成的分子晶体中一定只有极性共价键
若不断地升高温度,实现“雪花→水→水蒸气→氧气和氢气”的变化。在变化的各阶段被破坏的粒子间的主要相互作用力依次是
| A.氢键;分子间作用力;非极性键 | B.氢键;氢键;极性键 |
| C.氢键;极性键;分子间作用力 | D.分子间作用力;氢键;极性键 |
石墨烯是碳原子构成的单层二维蜂窝状晶格结构(如图2所示)的一种碳质新材料,是构建富勒烯、纳米碳管的基本单元,有广泛的用途。下列说法正确的是 ( )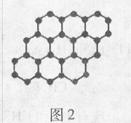
| A.石墨烯是一种有机物 |
| B.石墨烯中碳原子间以共价键结合 |
| C.石墨烯具有和乙烯相同的性质 |
| D.12g石墨烯中约含6.02×1023个e- |
下列物质加热熔化时破坏极性共价键的是
| A.干冰 | B.二氧化硅 | C.晶体硅 | D.氢氧化钠 |
下列说法正确的是
| A.分子晶体中,可能不存在共价键,但一定存在分子间作用力 |
| B.两种元素组成的分子中一定只有极性键 |
| C.只含共价键的物质,一定是共价化合物 |
| D.氧化还原反应中,一种元素化合价上升,一定有另一种元素化合价下降 |