2007年全国统一高考化学试卷(江苏卷)
三聚氰酸[]可用于消除汽车尾气中的。其反应原理为:
;
下列说法正确的是( )
| A. | 与 为同一物质 | B. | 是一种很强的氧化剂 |
| C. | 1 在反应中转移的电子为4 | D. | 反应中 是还原剂 |
在隔绝空气的条件下,某同学将一块部分被氧化的钠块用一张已除去氧化膜、并用针刺一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待钠块反应完全后,在容器中仅收集到1.12氢气(标准状况),此时测得铝箔质量比反应前减少了0.27 ,水槽和容器内溶液的总体积为2.0,溶液中的浓度为0.050-1(忽略溶液中离子的水解和溶解的氢气的量)。
(1)写出该实验中发生反应的化学方程式。
(2)试通过计算确定该钠块中钠元素的质量分数。
阿伏加德罗常数约为6.02×1023,下列叙述正确的是()
| A. | 2.24 中含有的原子数为0.3 ×6.02×10 23 |
| B. | 0.1 3 的 溶液中含有的 数目为0.3 ×6.02×10 23 |
| C. | 5.6 铁粉与硝酸反应失去的电子数一定为0.3 ×6.02×10 23 |
| D. | 4.5 晶体中含有的硅氧键数目为0.3 ×6.02×10 23 |
通常情况下,微粒和为分子,和为阳离子,为阴离子,它们都含有10个电子;溶于后所得的物质可电离出和;、、三种微粒反应后可得和一种白色沉淀。请回答:






(1)用化学符号表示下列4种微粒:: :: :。
(2)写出、、三种微粒反应的离子方程式:、。
钢铁工业是国家工业的基础。2006年我国粗钢产量突破4亿,居世界首位。某中学社会实践活动小组利用假期对当地钢铁厂进行了调研,对从矿石开始到钢铁产出的工艺流程有了全面的感性认识。请您对社会实践活动小组感兴趣的问题进行计算:
(1)将6.62铁矿石样品投入适量的盐酸中(充分反应),过滤,然后在滤液中加过量的溶液,充分反应后,过滤、洗涤、灼烧得4.80。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)
(2)取某钢样粉末28.12(假设只含和),在氧气流中充分反应,得到气体224。(标准状况)。
①计算此钢样粉末中铁和碳的物质的量之比。
②再取三份不同质量的钢样粉末分别加到l00相同浓度的。溶液中,充分反应后,测得的实验数据如下表所示:
| 实验序号 |
I |
Ⅱ |
Ⅲ |
| 加入钢样粉末的质量/ | 2.812 |
5.624 |
8.436 |
| 生成气体的体积/(标准状况) |
1.120 |
2.240 |
2.800 |
计算硫酸溶液的物质的量浓度。
③若在实验Ⅱ中继续加入钢样粉末,计算反应结束后剩余的固体质量为多少?(用含的代数式表示)
酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。
乙酸乙酯的实验室和工业制法常采用如下反应:
请根据要求回答下列问题:
⑴欲提高乙酸的转化率,可采取的措施有:、等。
⑵若用上图所示的装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为:
、等。
⑶此反应以浓硫酸为催化剂,可能会造成、等问题。
⑷目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)。
| 同一反应时间 |
同一反应温度 |
||||
| 反应温度/℃ |
转化率(/%) |
选择性(/%)* |
反应时间/ | 转化率(/%) |
选择性(/%)* |
| 40 |
77.8 |
100 |
2 |
80.2 |
100 |
| 60 |
92.3 |
100 |
3 |
87.8 |
100 |
| 80 |
92.6 |
100 |
4 |
92.3 |
100 |
| 120 |
94.5 |
98.7 |
6 |
93.0 |
100 |
| *选择性100%表示反应生成的产物是乙酸乙酯和水 |
①根据表中数据,下列(填字母)为该反应的最佳条件。
| A. | 120 ℃,4 | B. | 80 ℃,2 | C. | 60 ℃,4 | D. | 40 ℃,3 |
②当反应温度达到120 ℃时,反应选择性降低的原因可能为。
实验室常利用甲醛法测定样品中氮的质量分数,其反应原理为: [滴定时,1 与 l 相当],然后用标准溶液滴定反应生成的酸,某兴趣小组用甲醛法进行了如下实验:
步骤I 称取样品1.500。
步骤II 将样品溶解后,完全转移到250 容量瓶中,定容,充分摇匀。
步骤Ⅲ 移取25.00样品溶液于250锥形瓶中,加入1020%的中性甲醛溶液,摇匀、静置5 后,加入1~2滴酚酞试液,用标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:①碱式滴定管用蒸馏水洗涤后,直接加入标准溶液进行滴定,则测得样品中氮的质量分数(填"偏高"、"偏低"或"无影响")。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去标准溶液的体积(填 "偏大"、"偏小"或"无影响")
③滴定时边滴边摇动锥形瓶,眼睛应观察[]
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由色变成色。
(2)滴定结果如下表所示:

若标准溶液的浓度为0.1010则该样品中氮的质量分数为
下列有关实验的说法正确的是( )
| A. | 除去铁粉中混有的少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤 |
| B. | 为测定熔融氢氧化钠的导电性,可在瓷坩埚中熔化氢氧化钠固体后进行测量 |
| C. | 制备 胶体,通常是将F 固体溶于热水中 |
| D. | 某溶液中加入盐酸能产生使澄清石灰水变浑浊的气体,则该溶液中一定含有 |
下列溶液中各微粒的浓度关系不正确的是()
| A. | 0.1 溶液中: |
| B. |
1 L 0.1
的溶液中:
|
| C. | 0.1 溶液中: |
| D. | 等体积、等物质的量浓度的NaX和弱酸HX混合后的溶液中: |
某同学按右图所示的装置进行电解实验。下列说法正确的是()

| A. | 电解过程中,铜电极上有 产生 |
| B. | 电解一定时间后,石墨电极不可能有铜析出 |
| C. | 电解初期,主反应方程式为: |
| D. | 整个电解过程中, 的浓度不断增大 |
一定温度下可逆反应:+2 2+;<0。现将1 和2 加入甲容器中,将4 和2 加入乙容器中,此时控制活塞,使乙的容积为甲的2倍,时两容器内均达到平衡状态(如图1所示,隔板不能移动)。下列说法正确的是( )
2+;<0。现将1 和2 加入甲容器中,将4 和2 加入乙容器中,此时控制活塞,使乙的容积为甲的2倍,时两容器内均达到平衡状态(如图1所示,隔板不能移动)。下列说法正确的是( )

| A. | 保持温度和活塞位置不变,在甲中再加入1 和2 ,达到新的平衡后,甲中 的浓度是乙中 的浓度的2倍 |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲中 的体积分数增大,乙中 的体积分数减小 |
| C. | 保持温度不变,移动活塞 ,使乙的容积和甲相等,达到新的平衡后,乙中 的体积分数是甲中 的体积分数的2倍 |
| D. | 保持温度和乙中的压强不变, 时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示( 前的反应速率变化已省略) |
据估计,地球上的绿色植物通过光合作用每年能结合来自中的碳1500亿吨和来自水中的氢250亿吨,并释放4000亿吨氧气。光合作用的过程一般可用下式表示:
微量元素(等)  (蛋白质、碳水化台物、脂肪等)
(蛋白质、碳水化台物、脂肪等)
下列说法不正确的是
| A. | 某些无机物通过光合作用可转化为有机物 |
| B. | 碳水化合物就是碳和水组成的化合物 |
| C. | 叶绿素是光合作用的催化剂 |
| D. | 增加植被,保护环境是人类生存的需要 |
下列说法正确的是()
| A. |
原子晶体中只存在非极性共价键 |
| B. |
稀有气体形成的晶体属于分子晶体 |
| C. |
干冰升华时,分子内共价键会发生断裂 |
| D. |
金属元素和非金属元素形成的化合物一定是离子化合物 |
下列离子方程式书写正确的是
| A. | 过量的 通入 溶液中: |
| B. | 溶液中加入过量的 溶液: |
| C. |
溶液中加入酸性
溶液:
|
| D. | 溶液中加入过量的 溶液: ↓ |
花青苷是引起花果呈颜色的一种花色素,广泛存在于植物中。它的主要结构在不同条件下有以下存在形式:

下列有关花青苷说法不正确的是
A.花青苷可作为一种酸碱指示剂
B.I和Ⅱ中均含有二个苯环
C.I和Ⅱ中除了葡萄糖基外,所有碳原子可能共平面
D.I和Ⅱ均能与溶液发生显色反应
| A. |
|
B. |
|
某合金(仅含铜、铁)中铜和铁的物质的量之和为,其中的物质的量分数为 ,将其全部投入50 的硝酸溶液中,加热使其充分反应(假设是唯一的还原产物)。下列说法正确的是
| A. | 若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解 |
| B. | 若金属全部溶解,则溶液中一定含有 |
| C. | 若金属全部溶解,且产生336 气体(标准状况),则 |
| D. | 当溶液中金属离子只有 、 时,则 与 的关系为: |
肉桂醛是一种食用香精,它广泛用于牙膏、洗涤剂、糖果以及调味品中。
工业上可通过下列反应制备:
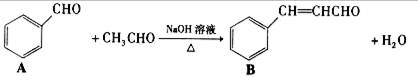
(1)请推测B侧链上可能发生反应的类型:(任填两种)
(2)请写出两分子乙醛在上述条件下反应的化学方程式:(3)请写出同时满足括号内条件下的所有同分异构体的结构简式:
(①分子中不含羰基和羟基②是苯的对二取代物③除苯环外,不含其他环状结构。)




 外,还得到它的同分异构体,
外,还得到它的同分异构体,
 粤公网安备 44130202000953号
粤公网安备 44130202000953号