某些化学键的键能如下表(kJ·mol—1):

(1)根据上表数据判定,H2和Cl2较稳定的是 ;
(2)1 mol H2在足量C12中燃烧,放出热量 kJ。
下列各项中表达正确的是
A.NaCl的电子式: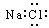 |
B.CO2的分子模型示意图: |
C.CrO5的结构式为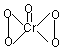 ,该氧化物中Cr为+6价 ,该氧化物中Cr为+6价 |
| D.次氯酸的结构式:H-Cl-O |
砷(As)在地壳中含量不大,但砷的化合物却是丰富多彩。
(1)基态砷原子的电子排布式为 ;砷与溴的第一电离能较大的是 。
(2)AsH3是无色稍有大蒜味气体。AsH3的沸点高于PH3,其主要原因是 。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为 ,与其互为等电子体的一种分子为 。
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为 ,As原子采取 杂化。
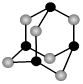
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似。GaAs晶体中,每个As与 个Ga相连,As与Ga之间存在的化学键有 (填字母)。
| A.离子键 | B.σ键 | C.π键 | D.氢键 E.配位键 F.金属键 G.极性键 |
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,用ClO2替代Cl2对自来水进行消毒是城市饮用水处理新技术。工业上制备ClO2的方法很多,可以用合适的还原剂还原NaClO3制得。
(1)在硫酸酸化的条件下用 草酸还原NaClO3制ClO2,其反应的化学方程式为 。
(2)工业以CH3OH与NaClO3为原料在酸性条件下制取ClO2,同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO3-+2Cl-+4H+=2ClO2↑+Cl2↑+2H2O。
①写出第二步反应的离子方程式 。
②工业生产时需在反应物中加少量Cl-,其作用是 。
(3)ClO2可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐,写出ClO2与NaOH溶液反应的离子方程式 。
(4)ClO2可用于含CN-废水的处理,产生的两种气体可以直接排入空气。
①已知CN-中C、N的最外层都满足8电子结构,写出CN-的电子式 。
②写出该反应的离子方程式 。
按要求完成下列问题:
(1)甲基的电子式_____________
(2)电石气的结构式_________________
(3)相对分子质量为72且沸点最低的烷烃的结构简式_______________
(4)顺式聚1,3-丁二烯的结构简式________________
(5)与H2加成生成2,5-二甲基己烷的炔烃的系统命名_________________
(6) 的系统命名
的系统命名
在下列物质中:NaCI、NaOH、Na2O2、H2O2、(NH4)2S、CCI4、C2H2、SiC、晶体硅、金刚石、SO3
①其中只含有离子键的离子晶体是 ;
②其中既有离子键,又有极性键和配位键的离子晶体是 ;
③其中既有离子键,又有非极性键的是 ;
④其中含有非极性键的非极性分子的是 ;
⑤其中含非极性键的极性分子的是 ;
⑥其中含有极性键的的原子晶体是 ;
五种短周期元素A、B、C、D、E,原子序数逐渐增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子层多3个。D周期序数等于D原子最外层电子数。E原子半径是同周期中最小的(除稀有气体外)根据以上信息回答下列问题:
(1)A、B、C、D、E五种元素的原子半径由小到大的顺序是 (用元素符号填写),其中D的最高价氧化物是 氧化物。
(2)乙物质中存在的化学键类型是 。
(3)化合物乙的电子式 。
(4)写出C与D的最高价氧化物对应的水化物反应的离子方程式 。
(5)E的单质通入C的最高价氧化物对应的水化物的溶液中反应生成的“84”消毒液的主要成分的化学式为 。
下表是元素周期表的一部分, 针对表中的①~⑧种元素,填写下列空白:
| 族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA[ |
零 |
| 2 |
|
|
|
① |
② |
③ |
|
|
| 3 |
④[ |
|
⑤ |
⑥ |
|
|
⑦ |
⑧ |
(1)上述元素中,化学性质最不活泼的是 (填元素符号)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 (填元素符号)。
(3)元素②的气态氢化物分子属于 (填电解质或非电解质);元素⑦与④形成化合物的电子式是 。
(4)元素⑤的最高价氧化物与氢氧化钠溶液反应的离子方程式为: 。
(5)元素④的某氧化物可作供氧剂,该氧化物中所含的化学键类型有 ,写出其与二氧化碳反应的化学方程式 。
(1、2、3班必做)根据题意回答下列问题
(1)写出基态Fe2+离子核外电子排布式 ;基态氟原子价电子排布图 。
(2)电负性:S O(填写“<”或“>”,下同));第一电离能:N F。H3O+空间构型是 ,SO32-离子中S杂化类型是 。
(3)HCN分子中σ键与π键数目之比为___________。
(4)与CN‑互为等电子体的分子是 (写分子式)。
用电子式表示下列物质的形成过程:
(1)CO2 ;
(2)NaCl 。
(1)可正确表示原子轨道的是: 。
| A.2s | B.2d | C.3p | D.3f |
(2)镓(Ga)原子序数为 ,写出其基态原子的电子排布式: 。
(3)S单质的常见形式为S8,其环状结构如下图所示,S原子采用的轨道杂化方式是 。
(4)用“>” “< ” “=” 填空:
第一电离能的大小:Mg Al;熔点的高低:KCl MgO。
(5)NO3-的空间构型为 (用文字描述)。
(6)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是 。CO与N2结构相似,CO分子内σ键与π键个数之比为 。
在下列物质中:①SiO2 ②NaOH ③Na2S ④H2O2 ⑤Na2O2 ⑥(NH4)2S ⑦CO2 ⑧CCl4 ⑨C2H4 ⑩金刚石.用序号填空:
(1)只含有离子键的是 _____;
(2)既含有离子键,又含有极性共价键和配位键的是 _____;
(3)既含有离子键又含有非极性共价键的是 _______;
(4)含有极性共价键和非极性共价键的非极性分子是 _____;
(5)含有极性共价键和非极性共价键的极性分子是 _________;
(6)熔化时只破坏极性共价键的是 _______
(8分)请选择合适选项填空(用字母序号填空):
| A.He |
| B.Cu |
| C.H2 |
| D.NaCl |
E.KOH
F.H2O
(1)属于共价化合物的是________;
(2)含共价键的单质有________;
(3)只含有离子键的化合物有________;
(4)既有离子键又有共价键的化合物_________。
在构成下列物质的微粒中:A氨气,B氯化钡 ,C氯化铵 ,D干冰 ,E苛性钠,F食盐,G冰,H氦气,I过氧化钠,J氢气 。
①只有共价键的是 ;
②只有离子键的是 ;
③既有离子键又有共价键的是 ;
④无任何化学键的是 ;