下列变化中 ①NaCl 溶于水 ②HCl 溶于水 ③O2 溶于水 ④Na2O2溶于水 ⑤I2升华 ⑥固体NaOH熔化。未发生化学键破坏的是 仅发生离子键破坏的是 ,仅发生共价键破坏的是 既发生离子键破坏,又发生共价键破坏的是 (填序号)。
(12分)在下列物质中:NaOH、Na2S、(NH4)2S、Na2O2、C2H2、SiC晶体。
(1)其中只含有离子键的离子晶体是 ;
(2)其中既含有离子键又含有极性共价键的离子晶体是 ;
(3)其中既含有离子键,又含有极性共价键和配位键的离子晶体是 ;
(4)其中既含有离子键又含有非极性共价键的离子晶体是 ;
(5)其中含有极性共价键和非极性共价键的非极性分子是 ;
(6)其中含有极性共价键的原子晶体是 。
I.下列各组物质:
① 、
、 、
、 ②石墨和C60 ③水和冰
②石墨和C60 ③水和冰
④正戊烷和异戊烷 ⑤35Cl2、37Cl2
其中,
(1)属于同分异构体的是 (填序号,下同)
(2)属于同素异形体的是
(3)属于同位素的是
II.下列6种固态物质:①P4 ②SiO2 ③NH4Cl ④NAF ⑤CO2(干冰) ⑥金刚石,
回答下列问题:
(1)熔化时不需要破坏化学键的化合物是 (填序号,下同)
(2)熔化时需要破坏共价键的单质是
(3)含有共价键的离子化合物是
下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
| 族 周期 |
IA |
|
0 |
|||||
| 1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
| 2 |
|
|
|
② |
③ |
④ |
|
|
| 3 |
⑤ |
|
⑥ |
⑦ |
|
|
⑧ |
|
(1)⑧的原子结构示意图为_________。
(2)②的气态氢化物分子的结构式为___________,②和⑦的气态氢化物的稳定性相比,其中较弱的是____(用该氢化物的化学式表示)。
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是 (填化学式)
(4)⑤、⑥元素的金属性强弱依次为___________(填“增大”、“减小”或“不变”)
(5)④、⑤、⑥的形成的简单离子半径依次_________(填“增大”、“减小”或“不变”)
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式: ,形成的晶体是 晶体。
化学上常用一条短线来表示一对共用电子对,用元素符号和短线来表示物质结构的式子叫结构式,例如Cl2的结构式用Cl-Cl表示,H2O的结构式用H-O-H表示。
(1)写出下列物质的结构式:
①CO2 ②N2 ;③CH4 ;④C2H4 。
(2)根据下列物质的结构式写出其相应的电子式:
①H―O―Cl_____; ②H-O-O-H_______;
③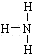 _____; ④H-C≡C-H 。
_____; ④H-C≡C-H 。
.根据要求的化学用语填写
(1)H2O2的电子式为_______________
(2)C2H2的结构式为__________________
(3)常温常压下,1g甲烷完全燃烧生成液态水时放出热量为556kJ,写出甲烷燃烧的热化学方程式__________________________________________________________________
(4)以Fe棒和Cu棒作为两极,氯化铁溶液作为电解质溶液,组成原电池,正极反应式为__________________________________,负极反应式为____________________________
(5)固体离子化合物的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子的最外层电子结构。它的电子式是____________________
(共10分)下表是元素周期表的一部分, 针对表中的①~⑨种元素,填写下列空白:
| 主族 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0族 |
| 2 |
|
|
|
① |
② |
③ |
|
|
| 3 |
④ |
|
⑤ |
|
|
⑥ |
⑦ |
⑧ |
| 4 |
⑨ |
|
|
|
|
|
|
|
(1)在这些元素中,化学性质最不活泼的是: (填具体元素符号,下同)。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_____________,碱性最强的化合物的电子式是:_____________。
(3)最高价氧化物是两性氧化物的元素是________;写出它的氧化物与氢氧化钠反应的离子方程式______。
(4)用电子式表示元素④与⑥的化合物的形成过程: ,该化合物属于 (填 “共价”或“离子”)化合物。
(5)表示①与⑦的化合物的电子式 ,该化合物是由 (填“极性”或“非极性”)键形成的。
(共4分)下列五种物质中 ①Ne ②H2O ③NH3 ④KOH ⑤Na2O(填写序号):只存在共价键的是 ,只存在离子键的是 ,既存在共价键又存在离子键的是 ,不存在化学键的是 。
A、B、C、D、E、F是原子序数小于20的四种元素,已知A元素+1价的阳离子与C的阳离子具有相同的电子层结构,B元素最高正价的绝对值与负价的绝对值之差等于6。1molC单质与足量的稀硫酸反应可生成1.5molH2,反应后C元素原子形成的离子和氖原子的电子层结构相同。以D元素为核心可以形成种类最多的一类化合物。E的单质是密度最小的物质。F原子的最外层电子数是核外电子总数的 ;
;
(1)写出A、C两元素最高价氧化物的水化物间反应的离子方程式___________________________;
(2)比较B与C元素形成离子的半径:B元素形成的离子半径______C元素形成的离子半径(填“>”、“=”或“<”)
(3)D与F形成的一种化合物是参与大气循环的气体,写出它的电子式________________;
有X、Y、Z、M 、N按原子序数依次递增的五种短周期元素,其中Z、M、N同周期,X、Z同主族且X是原子半径最小的原子;Y、N同主族,Z+与Y2—具有相同的电子层结构;M的单质晶体熔点高、硬度大,是一种重要的半导体材料。
(1)M的元素名称 ,N在元素周期表中的位置 。
(2)离子半径比较:r(Z+) r(Y2—)。
(3)X与Z形成的化合物A是 (填“离子化合物”或“共价化合物”),A与X2Y反应的化学方程式是 。
化合物A是一种不稳定的物质,它的分子组成可用OxFy表示,10mLA气体能分解生成15mLO2和10mLF2(同温同压下)。则:
(1)我们可以通过计算确定A的化学式,其中x= ,y= ;
(2)已知A分子中x个氧原子呈…—O—O—O—…链状排列,则A分子的电子式是 ,结构式是 。
(1)在1—18号元素中,能形成最稳定气态氢化物的元素是 ;与水或酸反应最剧烈的金属单质是 ;最高价氧化物的水化物中碱性最强的元素是 ;最高价氧化物的水化物中酸性最强的元素是 。(填写元素符号)
(2)物质在下列变化过程中克服的是:a分子间作用力 b共价键 c离子键(填序号)
①冰融化 ;
②食盐熔化 ;
③H2S受热分解成S和H2 ;
④NaHSO4溶解于水 ;
(3)共价键、离子键和分子间作用力是构成物质的微粒间的不同作用方式,下列物质中,只含有上述一种作用的是_________
| A.干冰 | B.氯化钠 | C.氢氧化钠 | D.碘 |
(4)氮化钠是科学家制备的一种重要的化合物,它与水作用可产生NH3。请回答,Na3N的电子式是________, Na3N与盐酸反应方程式_____________________________________;
(1)下列7种固态物质:
| A.P4 |
| B.SiO2 |
| C.NH4Cl |
| D.Ca(OH)2 |
E.NaF
F.CO2(干冰)
G.金刚石
回答下列问题(填字母代号):
①既有离子键又有共价键的是 。
②熔化时不需要破坏化学键的是 ,熔化时需要破坏共价键的是 。
(2)某元素最高正化合价为+6,其最低负价为 。某元素R与氢形成的气态氢化物的化学式为RH3,其最高价氧化物的化学式为 。
根据要求回答下列问题:
①CaBr2 ②H2O ③NH4Cl ④H2O2 ⑤Na2O2 ⑥Ca(OH)2 ⑦HClO ⑧Al
(1)只含有离子键的是 (用序号回答,下同)
(2)含有共价键的离子化合物是
(3)属于共价化合物的是
(4)熔融状态能导电的化合物是
(5)熔融状态时和固态时,都能导电的是
根据下面的描述,按照要求回答下列问题
(1)画出H2O2的电子式:__________
(2)请画出HClO的电子式:__________
(3)用电子式表示出离子化合物MgCl2的形成过程__________
(4)在短周期元素中,由三种非金属元素组成的既有离子键又有共价键,且阴阳离子含电子总数相等的物质,其化学式是__________,画出电子式_________
(5)某学生在一次探究“制取氢气最适宜的金属”的实验时,测得镁在与稀硫酸反应,10 s末硫酸的浓度减少了0.6 mol·L-1,若不考虑反应过程中溶液体积的变化,则10 s内生成硫酸镁的平均反应速率是__________mol·L-1s-1 。