推断题科学家们在探索生命奥妙过程中,认识到生命细胞的组成和元素周期律有密切的关系,约占人体质量99.97%的11种大量元素全部位于周期表前20号元素,其余的是十多种人体不可缺少的微量元素。现有a~g 7种短周期元素,是氧、硫、钾、钙外的其它大量元素,它们在元素周期表中的位置如下,并据此回答下列问题:
| a |
|
|
|||||
| |
|
|
d |
e |
|
|
|
| b |
c |
|
|
f |
|
g |
|
(1)元素的原子间最容易形成离子键的是下列中的 (填选项),元素的原子间最容易形成共价键的是下列中的 (填选项)。
A、c和f B、b和g C、d和g D、b和e
(2)下列由a~g形成的各分子中所有原子都满足最外层为8电子结构的是 (填选项)
A、ea3 B、ag C、fg3 D、dg4
按要求填空:
(1)羟基的电子式是 ;
(2)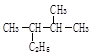 用系统命名法命名为 ;
用系统命名法命名为 ;
(3)2-甲基-1,3-丁二烯的键线式为 ;
(4)乙醛与银氨溶液反应的化学方程式: ____________________。
(1)完成下列物质的电子式
| A.Na+, | B.Cl-, | C.H2O, | D.Na2O2 , |
(2)用电子式表示下列化合物的形成过程
H2O ; MgCl2 。
有X、Y、Z、M 、N按原子序数依次递增的五种短周期元素,其中Z、M、N同周期,X、 Z同主族且X是原子半径最小的原子;Y、N同主族,Z+与Y2—具有相同的电子层结构;M的单质晶体熔点高、硬度大,是一种重要的半导体材料。
(1)M的元素名称 ,N在元素周期表中的位置 。
(2)离子半径比较:r(Z+) r(Y2—)。(填“>”、“=”或“<”)
(3)X与Z形成的化合物A是 (填“离子化合物”或“共价化合物”),A与X2Y反应的化学方程式是 。
(1)指出配合物K2[Cu(CN)4]的配离子、中心离子、配位体、配位数:______________________。
(2)在[Fe(CN)6]3-中,中心原子的配位数为__________,配体的立体构型是__________。
(3)配合物[Cr(H2O)4Br2]Br·2H2O中,中心原子的化合价为__________,内界的电荷数为__________。
(1)乙烯的结构式为__________________,乙炔的电子式为_______________________
(2)有机物 的名称是__________________________________;
的名称是__________________________________;
(3)CH2=CH-COOH与溴水反应的方程式 ____
与CH3CH218OH反应的方程式 ____
(7分)现有下列物质:①干冰;②氢氧化钠;③过氧化氢;④晶体硅;⑤过氧化钠;⑥醋酸钠;⑦溴化铵;⑧氖;⑨碘晶体;请用编号填写下列空白。
(1)只含极性键的物质有 。
(2)只含非极性键的物质有 。
(3)只含极性键和非极性键的物质有 。
(4)只含离子键和极性键的物质有 。
(5)只含离子键和非极性键的物质有 。
(6)既含离子键,又含极性键和非极性键的物质有 。
(7)不含化学键的物质有 。
(9分)(1)周期表前20号元素中,某两种元素的原子序数相差4,周期数相差1,它们形成化合物的原子数之比为1:1。写出这些化合物的化学式 。
(2)已知S2Cl2分子内所有原子的最外层均满足8电子结构,写出它的结构式 。
(3)碳与它非相邻的短周期元素以极性键形成的化合物中,各原子最外层都达到了8电子稳定结构,写出其中两种化合物的化学式 。
(4)1919年,Langmuir提出等电子原理:原子数相同、电子总数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。
①据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是 和 。
②此后,等电子原理又有所发展。例如,由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO2- 互为等电子体的分子有: 、 。
氮化钠(Na3N)是科学家制备的一种重要化合物。它与水作用可生成NH3 和一种强碱。回答下列问题:
(1)氮化钠的电子式是 ,该化合物是 化合物(选填“离子”、“共价”)。
(2)氮化钠与水反应的化学方程式是 ,该反应属于 反应。
(3)氮化钠与盐酸反应生成 种盐,其中 (填盐的化学式)既含离子键又含有共价键。
(4)氮化钠中两种微粒的半径大小比较:r(Na+) r(N3-)(填“大于”、“小于”或“等于”)。
(1)X的基态原子核外有3个原子轨道充满电子,其价电子排布式为________
(2)M+中3d能级的轨道在半充满状态其原子的电子排布式为________
(3)E元素原子核外有6种不同运动状态的电子,其最高价氧化物的分子的结构式为______,该分子中σ键与π键个数之比为 ,写出与该分子互为等电子体的分子的化学式为 。
(1)写出氯原子的原子结构示意图 ,NH4Cl的电子式 ;
(2)用电子式表示H2O的形成过程 ;
(3)已知一定条件下,白磷转化为红磷释放出能量,则等质量的白磷比红磷具有的能量 (填“高”、“低”),故白磷比红磷稳定性 (填“强”、“弱”),等质量的白磷和红磷充分燃烧均生成五氧化二磷, 放出热量多。
Ⅰ.在①CaCl2、②KOH、③CO2、④NaHSO4、⑤Na2O2、⑥Na2S、⑦N2中,只含有离子键的是________________,只含有共价键的是________________,含有非极性共价键的是__________________,既含有离子键又含有共价键的是____________,属于共价化合物的是____________。
Ⅱ.将NaHSO4溶于水,破坏的化学键是_______________,写出其电离方程式_____________________;NaHSO4在熔融状态下电离,破坏的化学键是_____________,写出其电离方程式____________________。
X、Y、Z、W是原子序数依次增大的短周期元素,X元素的族序数是周期序数的2倍;Y的单质在空气中燃烧生成一种淡黄色的固体;Z元素最高化合价与最低化合价绝对值之差等于4;W元素在周期表中位于非金属性最强的元素下方。请回答:
(1)X元素在周期表中的位置是 ;W-离子的结构示意图为 。
(2)X元素可形成多种气态氢化物,其中相对分子质量为26的气态氢化物的电子式为 ;25℃、101kPa时该气态氢化物热值为5×104 kJ•kg-1,则其标准燃烧热为 。
(3)写出一种适宜实验室制取W单质的离子方程式: 。
(4)室温时金可溶于王水(浓盐酸和浓硝酸混合物)生成HAuCl4,若反应过程中消耗的氧化剂与还原剂物质的量相等,则该化学方程式为 。
(15)H、C、N、O、Na、Cr是常见的六种元素。
(1)C位于元素周期表第____周期第___族;Cr的基态原子核外电子排布式为___________;C2H2分子中σ键与π键数目之比为____________。
(2)用“>”或“<”填空:
| 电负性 |
键长 |
键的极性 |
沸点(同压) |
| C_____N |
C=C_____C-C |
N-H____O-H |
甲醇____丁烷 |
(3)25℃、101kPa下:①2Na(s)+1/2O2(g)=Na2O(s) ΔH=-414kJ·mol-1
②2Na(s)+O2(g)=Na2O2(s) ΔH=-511kJ·mol-1
写出Na2O2与单质钠化合成Na2O固体的热化学方程式_________________________。
(4)我国已经立法规定酒驾入列。“酒精检测仪”中有红色CrO3和少量H2SO4,检测酒驾时产物有三价铬和CO2等,该反应的化学方程式为______________________________________。