(1)滑石一种硅酸盐矿物,其化学式为Mg3Si4O10(OH)2,用氧化物的形式表示为 。
(2)除去下列物质中所含杂质(括号内为杂质),写出除去杂质的试剂。
①Fe2O3(Al2O3) ②NO(NO2)
③Cl2 (HCl) ④FeCl3 (FeCl2)
(3)用铝箔包裹0.1mol金属钠,用针扎若干小孔,放入水中,完全反应后,用排水取气法收集到标准状况下气体的体积是_________(填字母序号)
a.1.12L b.>1.12L c.<1.12L
将128g铜置于一定量的浓硝酸中并微热。当铜片完全消失时,共收集到NO2和NO的混合气体44.8L(标准状况下)。
(1)写出上述过程中,有关反应的离子方程式______________、_____________。
(2)完成该反应至少需要量取10mol/L的浓硝酸__________mL。
(3)混合气体中NO2的体积为__________L,NO的体积为__________L(均为标准状况下)。
(4)将收集上述气体的容器倒扣在盛有水的水槽中,并向其中缓慢通入O2使其充分反应,若要使溶液恰好充满容器,则理论上需要参加反应的O2的物质的量为____________mol。
NO分子曾因污染空气而臭名昭著,但随着其“扩张血管、免疫、增强记忆”功能的发现,现在成为当前生命科学研究中的“明星分子”,回答下列问题:
(1)NO的危害在于 。
a.破坏臭氧层 b.参与酸雨和光化学烟雾的形成
c.与人体内血红蛋白结合 d.当它转化为N2后使空气中O2含量降低
(2)NH3与氧气反应可生成NO,化学方程式为 ;若参加反应的NH3为6 mol,则反应中转移了__________mol电子。
(3)一定条件下NO可转化为N2O和另一种红棕色气体,化学方程式为 。
(4)将0.05molNO和0.03molO2气体混合再以适当的速率缓慢通入盛有100mL水的集气瓶中,最终所得溶液中溶质的物质的量浓度为(设溶液体积变化忽视不计) 。
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题:
(1)稀盐酸不与Cu反应,若在稀盐酸中加入H2O2(常见氧化剂,作氧化剂时还原产物为水)后,则可使铜顺利溶解.该反应的化学方程式为: .
(2)在一定体积的10mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol.则浓硫酸的实际体积 (填“大于”、“等于”或“小于”)180mL.若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为 .
(3)镁铁混合物4.9g,溶解在过量的某浓度的稀硝酸中,完全反应后得到标准状况下2.24L NO 气体.若向反应后的溶液中加入足量的烧碱,则可生成沉淀的质量是 .
氮氧化物进入大气后,可能会形成硝酸型酸雨,因此必须对含有氮氧化物的废气进行处理。
(1)用NaOH可以吸收废气中的氮氧化物,反应的化学方程式如下:2NO2 + 2NaOH  NaNO2 + NaNO3 + H2O 反应中,还原剂是 ,NO2 + NO + 2NaOH
NaNO2 + NaNO3 + H2O 反应中,还原剂是 ,NO2 + NO + 2NaOH  2NaNO2 + H2O 反应中,氧化产物和还原产物之比为 。
2NaNO2 + H2O 反应中,氧化产物和还原产物之比为 。
(2)NO2和Br2蒸汽都是红棕色气体,下列可以用来鉴别这两种气体的试剂是 。
| A.用氢氧化钠溶液 | B.淀粉碘化钾溶液 | C.用硝酸银溶液 | D.用蒸馏水 |
(3)汽车尾气中含有一氧化氮和一氧化碳,消除这两种物质对大气污染的方法是安装催化转化器,使它们发生反应生成两种对大气无污染的气体,该反应的化学方程式为 。
(4)氨气也可用来处理氮氧化物,例如:氨气与二氧化氮反应生成氮气和水,写出该反应的化学方程式: ,若某工厂排出的废气中二氧化氮含量为0.5%(体积分数),处理1000m3(标准状况)这种废气,需要 千克氨气。(结果保留两位小数)
(1)地壳中含量最高的金属是 ,NaHCO3俗称 ,制造计算机芯片的半导体材料是 ,水晶项链的主要成分是 。
(2)在反应3Cu+8 HNO3(稀)="=" 3Cu(NO3)2+2NO↑+4H2O中,失去电子的是_________(填元素符号),被还原的是_______(填元素符号)。当产生标况下4.48 L气体时消耗单质铜 g,此时转移了_______ mol电子。
现有一定量铝粉和铁粉的混合物与一定体积稀硝酸充分反应,反应过程中无气体放出(硝酸的还原产物是NH4NO3)。在反应结束后的溶液中,逐滴加入2mol∙L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量的关系如图所示。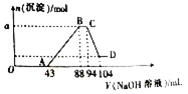
(1)写出OA段反应的离子方程式:____________________________。
(2)B点时溶液中含有溶质的化学式为____________。
(3)a的数值为__________。
(4)原硝酸溶液中HNO3的物质的量为__________mol。
氯碱工业生产中用氨气检查氯气管道是否泄漏,氨气遇到氯气会产生白烟,
(1)反应还生成了一种无毒的气态单质,写出反应的化学方程式 ________________________。
(2)在该反应中,氧化剂是____________,还原产物是____________,当有1.7g的氨气参与反应时,转移的电子数目为____________。
(3)列式计算当有112 mL的氯气(已折算到标准状况)参加反应时生成白烟的质量为________ g。
某些化学反应可表示为: A + B → C + D+H2O(未注明反应条件)请回答下列问题:
(1)若A、C、D均含氯元素,且A的化合价介于C与D之间,写出该反应的离子方程式:
。
(2)若A为紫红色金属,D为红棕色气体,请写出该反应的化学方程式:
。
(3)若A为不含金属元素的盐,B为碱,则检验气体C的方法是: 。
(4)若C、D均为气体且都能使澄清石灰水变浑浊,则A与B的组合是 。
在浓硝酸中放入铜片发生反应:
(1)待反应停止后,若铜有剩余,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,原因是 (用离子方程式表示)
(2)若将12.8g铜跟一定量的浓硝酸反应,铜耗完时,共产生气体5.6L(标况)。则所消耗硝酸的物质的量是 mol
(3)将收集上述气体的容器倒扣在盛有水的水槽中,并向其中缓慢通入O2,使其充分反应,若要使水恰好充满容器,理论上需要参加反应的O2的物质的量是 mol
为测定一种复合氧化物材料的组成。称取12.52g样品,将其全部溶于过量稀硝酸后,配成100ml溶液。取其一半,加入过量K2SO4溶液,生成白色沉淀,经过滤、洗涤、烘干后得4.66克固体。在余下的50毫升溶液中加入少许KSCN溶液, 显红色;如果加入过量NaOH溶液,则生成红褐色沉淀,将沉淀过滤、洗涤、灼烧后得3.20克固体。计算确定该材料的化学式为 。
硝酸是一种重要的化工原料,工业上一般以氨气为原料来制备硝酸。请回答:
(1)氨气催化氧化的化学方程式为______________________。
(2)氨气若在纯氧中燃烧,则发生反应为4NH3+3O2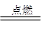 2N2+6H2O,科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是________(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为______________________。
2N2+6H2O,科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极是________(填“正极”或“负极”);碱性条件下,该电极发生反应的电极反应式为______________________。
(3)纳米级Cu2O具有优良的催化性能,制取Cu2O的方法有:
①加热条件下用液态肼(N2H4)还原新制Cu(OH)2制备纳米级Cu2O,同时放出N2.该制法的化学方程式为______________________。
②用阴离子交换膜控制电解液中OH-的浓度制备纳米Cu2O,反应为2Cu+H2O Cu2O+H2↑,如图所示.该电解池的阳极反应式为______________________。
Cu2O+H2↑,如图所示.该电解池的阳极反应式为______________________。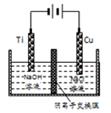
氨气在工农业生产中有重要应用。
Ⅰ. (1)如下图所示,向NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象。

①浓盐酸液滴附近会出现白烟,发生反应的化学方程式为_____________________。
②FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括Fe2++2NH3·H2O=Fe(OH)2↓+2NH和________________________。
(2)已知氨气极易溶于水,而难溶于有机溶剂CCl4。下列装置中不适宜做氨气尾气吸收的是 。

Ⅱ.现代传感信息技术在化学实验中有广泛的应用。

某小组用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理(图1)。
(1)关闭a,将吸有2mL水的胶头滴管塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈瓶内气压变化曲线(图2)。图2中 点时喷泉最剧烈。
(2)从三颈瓶中量取25.00mL氨水至锥形瓶中,加入 做指示剂;用0.0500 mol•L-1HCl滴定。终点时溶液颜色由 色变为 色,用pH计采集数据、电脑绘制滴定曲线如下图。

(3)据图,计算氨水的浓度为 mol•L-1;比较当VHCI=17.50ml时溶液中离子浓度大小关系 。
(4)关于该滴定实验的说法中,正确的是 。
| A.锥形瓶中有少量蒸馏水导致测定结果偏低 |
| B.酸式滴定管在滴定前有气泡,滴定后气泡消失测得氨水的浓度偏高 |
| C.酸式滴定管未用盐酸润洗会导致测得氨水的浓度偏高 |
| D.滴定终点时俯视读数会导致测得氨水的浓度偏低 |
氮是一种重要的非金属元素,可以形成多种不同类型的化合物,请根据要求回答下列问题:
(1) 表示阿伏加德罗常数的数值,69g
表示阿伏加德罗常数的数值,69g 和
和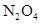 的混合气体中含有__________个氧原子;2L 0.6 mol/L
的混合气体中含有__________个氧原子;2L 0.6 mol/L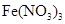 溶液中含_________个
溶液中含_________个 离子。
离子。
(2)三氟化氮( )是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:
)是一种无色,无味的气体,它是微电子工业技术的关键原料之一,三氟化氮在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有: 、
、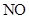 和
和 ,
,
① 写出该反应的化学方程式 .
若反应中生成0.15 mol  ,转移的电子数目为________个.
,转移的电子数目为________个.
②三氟化氮可由氨气和氟气反应得到: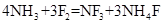 ;据题意推测
;据题意推测 ,
, ,
,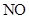 三种气体中,氧化性由强到弱的顺序为____________________
三种气体中,氧化性由强到弱的顺序为____________________
③ 是一种无色、无臭的气体,一旦
是一种无色、无臭的气体,一旦 泄漏,可以用
泄漏,可以用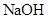 溶液喷淋的方法减少污染,其产物除
溶液喷淋的方法减少污染,其产物除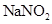 、
、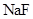 、
、 外,还肯定有_____________(填化学式).
外,还肯定有_____________(填化学式).
(3)氨和联氨(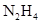 )是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式 。
)是氮的两种常见化合物,制备联氨可用丙酮为催化剂,将次氯酸钠与氨气反应,该反应中还原剂与氧化剂的物质的量之比为2:1,写出该反应的化学方程式 。
氮元素在自然界中存在多种价态,结合题干回答下列问题:
23.氮元素原子核外有 个未成对电子,最外层有 种能量不同的电子。
24.氮和磷是同主族元素,下列能说明二者非金属性相对强弱的是 (填编号)。
a.NH3比PH3稳定性强
b.氮气与氢气能直接化合,磷与氢气很难直接化合
c.硝酸显强氧化性,磷酸不显强氧化性
d.氮气常温是气体,磷单质是固体
25.已知,氯胺NH2Cl熔点-66℃,NH4Cl熔点340℃,氯胺的电子式为 ,从物质结构的角度解释两者熔点相差较大的原因 。
26.NH2Cl比HClO稳定性高,易水解,因水解后能产生可杀菌消毒的物质而成为饮用水的缓释消毒剂,NH2Cl发生水解的化学方程式为 。
27.工业上利用铝粉除去含氮废水中的NO3-,当控制溶液pH在10.7左右时,反应过程中生成AlO2-、氮气和氨气,若氮气和氨气的体积比为4:1,则还原剂和氧化剂的物质的量之比为 ,若氮气和氨气的体积比为1:1,则除去0.1mol NO3-,消耗铝______g。