某氮肥NH4HCO3中混有少量(NH4)2CO3,现采用下列方案测定该氮肥中(NH4)2CO3的质量分数:称取5.7 g上述样品与2.0 mol/L NaOH溶液混合,完全溶解后,低温加热使其充分反应(该温度下铵盐不分解),并使生成的氨气全部被硫酸吸收,测得氨气的质量与所用NaOH溶液体积的关系如图所示: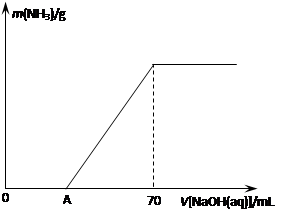
请回答下列问题:
⑴A点前样品与NaOH反应的离子方程式为 ▲ 。
⑵为使生成的氨气被硫酸吸收时不发生倒吸,可以选用下列装置中的 ▲ 。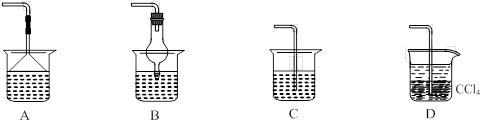
⑶样品中(NH4)2CO3的质量分数是 ▲ %(保留一位小数)。
⑷当V[NaOH(aq)]="50" mL时,生成NH3的质量为 ▲ 。
氨是一种重要的化工产品,其化学式为 ,具有 气味,密度比空气的 (填“大”或“小”), (填“易”或“难”)溶于水,因此,收集氨气应采用_______________法。
发射航天火箭常用氮的氢化物肼(N2H4)作燃料。试回答下列有关问题:
(1)N2H4燃烧时用NO2作氧化剂,它们相互反应生成氮气和水蒸气。
则N2H4和NO2反应生成氮气和水蒸气的热化学方程式为 。
(2)利用肼、氧气与KOH溶液组成碱性燃料电池,氮元素被氧化后只生成氮气,请写出该电池工作时负极的电极反应 ;电池工作时, 极pH升高。
(3)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的化学方程式 。
(4)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。写出盐酸肼第一步水解反应的离子方程式 。
氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应的氧化剂是 ,其还原产物是 ;
(3)该反应产生标准状况下11.2升CO气体,则电子转移 摩尔。
(4)若有1摩尔焦炭与足量的SiO2、氮气反应,电子转移 (填大于、等于或小于)2摩尔,理由是 。
氨是最重要的氮肥原料。在课本里学到的合成氨技术叫哈伯法,近一个世纪,合成氨需要高温高压似乎是天经地义了。然而,最近有两位希腊化学家在《科学》杂志上发表文章说,在常压下把氢气和用氦气稀释的氮气分别通入一个加热到570℃的电解池(如图),氢气和氮气便可在电极上合成氨,转化率竟然高达78%。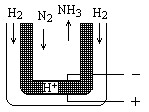
请根据以上材料回答下列问题:
(1)写出哈伯法合成氨的化学方程式: ;其反应条件中,符合平衡移动原理的反应条件是
(2)新法合成氨的电解池中能否用水溶液作电解质? (填“能”、“不能”)
为什么?
(3)电解池中,阳极发生 (填得或失)电子氧化反应,变价元素化合价 (填升高或降低)
(4)新法合成氨中所用的电解质(如图中黑细点所示)能传导H+,试写出电极反应式和总反应式。阳极: ;阴极___________________________
总反应式:__________________________________。
氨是氮循环过程中的重要物质,氨的合成是目前普遍使用的人工固氮方法。
(1)已知:H—H键能为436 kJ/mol, 键能为945 kJ/mol,N—H键能为391 kJ/mol。写出工业合成氨反应的化学方程式 ;由键能计算说明此反应是 反应(填“吸热”或“放热”),合成氨反应(消耗1molN2 时)的△H = 。
键能为945 kJ/mol,N—H键能为391 kJ/mol。写出工业合成氨反应的化学方程式 ;由键能计算说明此反应是 反应(填“吸热”或“放热”),合成氨反应(消耗1molN2 时)的△H = 。
(2)恒温下,向一个2L的密闭容器中充入1 mol N2和2.6 mol H2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
| 时间/min |
5 |
10 |
15 |
20 |
25 |
30 |
| c(NH3)/(mol/L) |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
5min内,用N2浓度的变化表示的反应速率为 ,此条件下该反应的化学平衡常数K= ;反应达到平衡后,保持温度、容积不变,若向平衡体系中加入0.4 mol N2 、 1 mol H2和0.2 mol NH3 ,化学平衡将
向 方向移动(填“正反应”或“逆反应”)。
(3)氨是氮肥工业的重要原料。某化肥厂生产铵态氮肥(NH4)2SO4的工艺流程如下:
①向沉淀池中加入CaSO4悬浊液后,需先通入足量NH3,再通入CO2的原因是 。操作Ⅰ的名称是 。
②煅烧炉中产生的固态副产品为 ,生产流程中能被循环利用的物质X为 。
氨的催化氧化是工业上制硝酸的基础:4NH3+xO2 4NO+6H2O。该化学方程式中x的数值是 ,其中作为还原剂的物质是 (填化学式);若反应中生成了4 mol NO,则需消耗 mol NH3。
4NO+6H2O。该化学方程式中x的数值是 ,其中作为还原剂的物质是 (填化学式);若反应中生成了4 mol NO,则需消耗 mol NH3。
运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)发射卫星时可用肼(N2H4)作燃料,其方程式为:N2H4+O2=N2+2H2O,若将此反应设计成如图所示的原电池装置,请回答:
①负极反应式为: ▲ ;
②工作一段时间后正极附近溶液的pH变化为 ▲ (填“增大”“减小”或“不变”);
③若用该电池电解以石墨为电极的100mL氯化铜溶液,一段时间后,两极均收集到2.24L气体(已换算成标准状况下的体积),则原溶液中Cu2+的物质的量浓度为 ▲ 。
(2)在25℃时,向浓度均为0.1mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,首先生成 ▲ 沉淀(填化学式),生成该沉淀的离子方程式为 ▲ 。(已知25℃ Ksp[Mg (OH)2]=1.8×10-11,Ksp[Cu (OH)2]=2.2×10-20)。
(3)在25℃时,将a mol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)= c(Cl-),则溶液显 ▲ 性(填“酸”“碱”或“中”),用含a的代数式表示NH3· H2O的电离常数kb= ▲ 。
氮是地球上极为丰富的元素。2004年7月德俄两国化学家共同宣布,在高压下氮气会发生聚合得到高聚氮,晶体片段结构如图所示。每个氮原子都通过3个单键与其它氮原子结合并向空间发展构成立体网状结构。这种高聚氮的N-N键的键能为160kJ/mol,而N2的键能为942kJ/mol。
⑴请根据以上信息写出固态高聚氮爆炸成氮气的热化学方程式: 。
⑵N≡N的键能为942 kJ·mol-1,N-N单键的键能为247 kJ·mol-3,计算说明N2中的 键比 键稳定(填“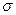 ”“
”“ ”)。
”)。
⑶Li3N晶体中氮以N3-存在,基态N3-的电子排布式为 
⑷2008的秋天,毒奶粉事件震惊全国,这主要是奶粉中含有有毒的三聚氰胺
(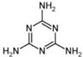 )。
)。
下列关于三聚氰胺分子的说法中正确的是 。
A.所有碳原子采用sp2杂化,所有氮原子采用sp3杂化
B.一个分子中共含有15个σ键
C.属于极性分子,故极易溶于水
D.形成的晶体熔点较高
⑸继C60后,科学家又合成了N60、Si60、KnC60等,C、Si、N、K原子电负性由大到小的顺序是 > > > 。
A、B、C、D、E是五种中学常见的单质,已知A、B、C、D在常温下均为气态,其中D能分别跟A、B、C在一定条件下两两化合,生成化合物X、Y、Z;A与B、C均不能直接化合,有关的转化关系如下图所示(反应条件均已略去)回答下列问题:
⑴Z分子的空间构型为
⑵反应③中被氧化的物质与被还原的物质的物质的量之比为 。
⑶Z和W在催化剂作用下,反应生成C和Y,这是一个很有实际意义的反应,可以消除W对环境的污染,该反应的方程式为 。
⑷将过量的E加到N的稀溶液中,若过程中转化的电子数目为3.02×1023个,则参加反应的E的物质的量为 mol。
⑸将Z和N反应后的产物溶于水中,则溶液的pH值(填“<”或“>”) 7,其原因是(用离子方程式表示) 。
已知:6.4克铜与适量的浓硝酸反应,当铜完全溶解后,共收集到NO和NO2混合气体共2.24升(已折算为标准状况)。
(1)写出有关反应的离子方程式 ;
。
(2)被还原的HNO3的物质的量为 ;
(3)参加反应的HNO3的物质的量为 。
(Ⅰ)工业上合成氨是在一定条件下进行如下反应:N2(g)+3H2(g) 2NH3(g),其部分工艺流程如下:
2NH3(g),其部分工艺流程如下:
回答下列问题:
⑴已知:N2(g)+O2(g) =2NO(g);△H=180.5kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ;△H=-905kJ/mol
2H2(g)+O2(g)=2H2O(g) ;△H=-483.6kJ/mol
则N2(g)+3H2(g) 2NH3(g)的△H=_________________。
2NH3(g)的△H=_________________。
(2)假如该厂生产的氨水的pH=a,加入相同体积的盐酸时,溶液呈中性,则此盐酸的pH_________14-a,此时c(NH4+)________c(Cl-)(填“大于”“小于”或“等于”)。
Ⅱ:(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa
时,16.0gN2H4在氧气中完全燃烧生成氮气,放出热量312kJ,写出表示N2H4燃烧热的热化学方程式是 。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液。肼—空气燃料电池放电时:
正极的电极反应式是 。
负极的电极反应式 。
(3)图是一个电化学过程示意图。
①锌片上发生的电极反应是 。
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气体积含量为20%)
氨气是一种重要工作原料,在工农业生产中具有重要的应用。
(1)已知:N2(g)+O2(g)="2NO(g) " △ H=180.5kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H=-905 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
则N2(g)+3H2(g)=2NH3(g)的△H=_________________________。
(2)工业合成氨气的反应为N2(g)+3H2(g)  2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是__________________。
2NH3(g)。在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是__________________。
①增大压强 ②增大反应物的浓度 ③使用催化荆 ④降低温度
( 3 )①实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取氨气,写出反应的化学方程式 。实验室还可在 (填一种试剂)中滴加浓氨水的方法快速制取少量氨气。
②常温下氨气极易溶于水,溶液可以导电。氨水中水电离出的c(OH-) 10-7 mol·L-1(填写“>”、“<”或“=”);
③将相同体积、PH之和为14的氨水和盐酸混合后,溶液中离子浓度由大到小的顺序
为 。
(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景。现用氢氧燃料电池进行图所示实验:(其中a、b均为碳棒)
①氢氧燃料电池具有广阔的发展前景。如下图所示:
右边Cu电极反应式是 。
a电极的电极反应式
②工业上生产氢气是将水蒸气通过红热的炭,产生水煤气:
C(s) + H2O(g)  H2(g) + CO(g) △H =" +131.3" kJ/mol
H2(g) + CO(g) △H =" +131.3" kJ/mol
该反应在低温下不能自发进行的原因是 。
| A.△H >0 | B.温度较低时,△H影响为主 |
| C.△S<0 | D.温度较低时,△S影响为主 |
写出除去下列气体中少量杂质(括号内物质)的方法:
⑴N2(O2) ;⑵NO(NO2) ;
⑶CO2(HCl) ;⑷NH3(H2O) 。