某厂每天产生800m3含氮的废水(NH3的含量为168mg∙L-1)。该厂处理废水的方法是:将废水加热得到NH3,使废水中NH3的含量降为15mg∙L-1(假设废水处理前后体积不变)。再对加热蒸发得到的NH3进一步处理制取硝酸。
(1)制取硝酸过程中主要发生反应如下:①_________________,②4NO+3O2+2H2O=4HNO3。反应①是氨气在一定条件下被氧气氧化,请在横线上写出该反应的化学方程式。
(2)该厂每天通过加热蒸发可得到NH3的物质的量是__________________。
(3)若在反应①中N元素损失10%,则该厂每天可生产硝酸多少吨?(写出计算过程,结果保留2位小数)
硝酸在有机合成、医药化工、化纤等行业应用非常广泛。工业上用氨催化氧化法可生产硝酸,其生产过程可表示为:
4NH3+5O2 4NO+6H2O ①
4NO+6H2O ①
4NO+3O2+2H2O→4HNO3 ②
完成下列计算:
(1)如果以一定量的氨气在一密闭容器中与足量氧气发生上述反应,冷却后所得溶液中溶质的质量分数是 (保留至1%)。
(2)某化肥厂以氨为原料通过题干中反应先产生硝酸,再利用氨气和硝酸反应制NH4NO3,已知由氨制 NO 的产率是 96%,NO 制硝酸的产率是 92%,氨被硝酸的吸收率为100%,则制备80吨 NH4NO3所需氨的体积(标准状况)为 m3(保留整数部分)。
氢气是化工行业重要原料之一。
(1)电解饱和食盐水是生产H2的方法之一。常温下,电解250 mL饱和食盐水一段时间后,溶液质量减轻0.365 g(假设气体全部逸出)。生成的氢气在标准状况下的体积为 mL。
(2)在电弧炉中,甲烷裂解产生乙炔和氢气,若1 m3 甲烷经此过程生成0.27 m3氢气,则甲烷的裂解率为 %(体积均在相同条件下测定)。
(3)已知:CxHy + H2O → CO + CO2 + H2(未配平)。工业上用甲烷、乙烷的混合气体利用上述反应生产氢气,反应后气体经干燥组成如下表所示:
| 组分 |
CO |
CO2 |
H2 |
| 体积分数 |
20% |
5% |
75% |
计算原混合气体中甲烷与乙烷的物质的量之比。
(4)合成氨生产过程中,消耗氮氢混合气2000 m3(其中CH4的体积分数为0.112%,下同),分离液氨后的氮氢混合气中含CH4 2.8%。计算分离出液氨为多少吨(保留2位小数,所有体积均已折算至标准状况)。
有一硫酸与硝酸的混合溶液100 ml,取出10 mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀;滤液与4.0 mol•L-1NaOH溶液反应,用去35 mL碱液时恰好完全中和。试求:原混合液中H2SO4的物质的量浓度是多少?HNO3的物质的量是多少?
(本题共14分)中学化学中有许多与氮有关的反应。阅读材料,回答问题。
氨气和氧气在催化剂存在下的反应方程式为4NH3十5O2→4NO+6H2O完成下列计算:
①生成1molNO消耗氧气的体积为 L(标准状况)。
②5 mol NH3和5 molO2反应生成4 molNO,过量的氨溶于产物水中成为氨水,所得氨水的密度为0.75g/ml,则该氨水的物质的量浓度为_____mol/L。
③.如果没有催化剂,氨氧化生成NO的同时也生成氮气:4NH3十3O2→2N2+6H2O。若4 mol NH3和4 molO2恰好完全反应,则产物气体中NO的物质的量为_____ mol。
已知真空管中反应2NO2
 N2O4,现向一真空管中充入4L标况下的NO2气体:
N2O4,现向一真空管中充入4L标况下的NO2气体:
① 若在上述反应中有50% NO2的转化为N2O4,所得混合气的平均摩尔质量为______g/mol
若在上述反应中有50% NO2的转化为N2O4,所得混合气的平均摩尔质量为______g/mol (保留一位小数)。
(保留一位小数)。
② 将4LNO2通过真空管反应后,恢复到原状况,得到气体3L,其中NO2为_______L。
将4LNO2通过真空管反应后,恢复到原状况,得到气体3L,其中NO2为_______L。
各种氮氧化物(NO、NO2)是主要的大气污染物之一,治理氮氧化物(NOX)废气的方法之一是用NaOH溶液进行吸收,其反应原理可表示如下:
NO2+NO+2NaOH→2NaNO2+H2O 2NO2+2NaOH→ NaNO2+NaNO3+H2O
现有一NO与NO2的混合气体,将其通入50mL 2mol/L的NaOH溶液中,恰好完全吸收,测得溶液中含有NO3―0.02mol。
①所得溶液中NaNO2的物质的量为 mol;②混合气体中V(NO):V(NO2)= 。
将一定质量由Cu和CuO组成的固体粉末加入到100 mL 11 mol/L的浓HNO3中,充分反应后,固体溶解完全,收集到NO、NO2混合气体6.72 L(标准状况)。若将该混合气体与2.24 L O2(标准状况)混合并通入到足量水中,恰好生成HNO3。
(1)NO的体积是 L,NO2的体积是 L(标准状况)。
(2)固体粉末中Cu单质的质量是 g。
(3)向浓HNO3反应后的溶液中加入4 mol/L的NaOH溶液,当Cu2+恰好沉淀完时,需要NaOH溶液的体积是 L。
在500mL 0.2 mol·L-1的稀硝酸中加入1.92g铜片,让其充分反应。试求:
(1)产生的气体在标准状况下所占的体积为多少?
(2)反应后溶液中H+的物质的量浓度是多少?(溶液体积变化忽略不计)
某结晶水合物A含有两种阳离子和一种阴离子。将溶有90.60gA的水溶液分成两等份,向第一份逐滴加入NaOH溶液,溶液先出现白色沉淀后完全溶解,此过程中产生2.24 L(标准状况)刺激性气味的气体。向第二份加入过量的Ba(OH)2溶液,过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.60 g。
请回答以下问题:
(1)试通过计算确定该结晶水合物的化学式为 ;
(2)若第二份加入75.00 mL2.00 mol·L-1的Ba(OH)2溶液,则得到的沉淀质量为 。
将标准状况的NO2、NH3、N2组成的混合气体10L,通过稀HNO3溶液,溶液的质量增加了12.5g,气体的体积缩小到3.28L。求混合气体各成分的体积。
19.2gCu加入到100mL一定浓度的HNO3溶液中,假定两者恰好完全反应,同时产生标准状态下8.96LNO和NO2混合气体(忽略气体的溶解及转化)。求:
(1)混合气体中NO2和NO的体积比 ?
(2)HNO3溶液的物质的量浓度?
有50mL某气体,可能含有CO2、O2、NH3等气体,将其通过浓H2SO4没有发现体积变化。通过足量Na2O2后,体积变为30mL,则该气体可能为
| A.CO2为20mL,NH3为30mL | B.NH3为40mL,O2为10mL |
| C.CO2为30mL,O2为20mL | D.CO2为40mL,O2为10mL |
(本题共14分)氨在工业生产中有广泛的用途。
54.某工厂平均每天产生约600 m3废氨水(该氨水浓度为153 mg/L,密度为1 g/cm3),该废氨水中氨的物质的量浓度为_____________。
55.若含0.800 mol NH3的某氨水溶液质量为54.0 g,向该溶液通入二氧化碳至反应完全,析出晶体后过滤,得到滤液31.2g,则NH4HCO3的产率为_______%。(保留1位小数)
56.NH3常用于制备NO。4NH3+5O2 →4NO+6H2O;(不考虑NO与氧气的反应),设空气中氧气的体积分数为0.20,氮气体积分数为0.80。为使NH3恰好完全氧化为NO,氨—空气混合物中氨的体积分数为________。
57.硫酸工业的尾气可以使用氨水进行吸收,既防止了有害物质的排放,也同时得到副产品氮肥。已知吸收尾气后的氨水全部转化为铵盐。取两份相同体积的铵盐溶液,一份中加入足量硫酸,产生0.09mol SO2(假设气体已全部逸出,下同);另一份中加入足量Ba(OH)2,产生0.16mol NH3,同时得到21.86g沉淀。通过计算,求铵盐溶液中各溶质成分与物质的量浓度之比。
(本题共14分)已知:硝酸铜受热易分解。
170℃时,2Cu (NO3)2 2CuO
2CuO 4NO2↑
4NO2↑ O2↑开始分解,至250℃分解完全。(其中2NO2
O2↑开始分解,至250℃分解完全。(其中2NO2 N2O4,2NO2
N2O4,2NO2 2NO
2NO O2等反应忽略不计)。
O2等反应忽略不计)。
800℃时,4CuO 2Cu2O
2Cu2O O2↑ 开始分解,至1000℃以上分解完全。
O2↑ 开始分解,至1000℃以上分解完全。
54.取5.64g无水硝酸铜,加热至1000℃以上,将生成的气体导入足量的NaOH溶液充分吸收后,还有逸出的气体是 (填分子式),体积(标准状况)为 ;将吸收液加水稀释到100mL,此溶液中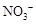 的物质的量浓度为 。
的物质的量浓度为 。
55.取5.64g无水硝酸铜加热至某温度分解后的残留固体中含有1.60g CuO,则残留固体的质量可能是 。
实验证明,当温度达到1800℃时,Cu2O也会发生分解:2Cu2O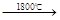 4Cu
4Cu O2↑
O2↑
56.取8.00g CuO,加热到1800℃左右,冷却后称得质量为6.88g,通过计算求出反应后剩余固体中各成分的物质的量之比。
57.取8.00g CuO,通入一定量H2并加热,使其部分还原为Cu和Cu2O,且其中n (Cu2O) n (Cu)
n (Cu)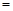 x。将此混合物溶于足量的稀硫酸中(Cu2O
x。将此混合物溶于足量的稀硫酸中(Cu2O 2H
2H
 Cu
Cu Cu
Cu
 H2O),充分反应后过滤得到Cu y g,试求未被还原的CuO的物质的量(用含x、y的代数式表示)。
H2O),充分反应后过滤得到Cu y g,试求未被还原的CuO的物质的量(用含x、y的代数式表示)。
向27.2 g Cu和Cu2O的混合物中加入某浓度的稀硝酸0.5 L,固体物质完全反应,生成NO和Cu(NO3)2。在所得溶液中加入1.0 mol·L-1的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为39.2 g。求
①混合物中Cu的质量
②产生的NO在标准状况下的体积