河北省唐山市高一上学期期末考试化学试卷
2015年11月世界气候大会再次提出全球变暖的问题。下列物质属于温室气体的是( )
| A.SO2 | B.NO2 | C.O2 | D.CO2 |
下列分散系中,分散质粒子直径最小的是( )
| A.雾霾 | B.乳浊液 | C.NaCl溶液 | D.氢氧化铁胶体 |
下列物质混合后均有颜色变化,其中属于物理变化的是( )
| A.一氧化氮和氧气 | B.胆矾和浓硫酸 |
| C.碘水和四氯化碳 | D.淀粉碘化钾溶液和氯水 |
下列物质的化学式与俗称不相符的是( )
| A.Na2CO3—苏打 | B.BaCO3—重晶石 |
| C.NH4NO3—硝铵 | D.NaOH—火碱 |
2015年8月12日位于天津滨海新区某一危险品仓库发生大爆炸,人员和财产损失严重。为此我们应做好各类安全预案。下列行为符合安全要求的是( )
| A.金属钠着火时,立即用水灭火 |
| B.配制稀硫酸时将水倒入浓硫酸中 |
| C.用点燃的火柴在液化气钢瓶口检验是否漏气 |
| D.大量氯气泄漏时,迅速离开现场并尽量往高处走 |
同位素的发现能揭示物质微观结构与性质之间的关系。下列说法正确的是( )
| A.O2和O3互为同位素 | B.1个15O2中含有18个中子 |
| C.18O2与16O2的性质完全相同 | D.16O和18O的核外电子数相同 |
下列有关硅及其化合物的性质和用途正确的是( )
①SiO2可用来制造半导体器件;②硅可用于制造光导纤维;
③高温下,SiO2与焦炭反应制取硅;④SiO2溶于水制硅酸。
| A.③ | B.①②③ | C.③④ | D.②③④ |
下列气体的实验室制法正确的是( )
| A.Cl2:电解饱和食盐水 | B.O2:过氧化氢与二氧化锰混合 |
| C.H2:锌粒和稀硝酸混合 | D.NH3:氮气和氢气混合 |
下列物质既能与盐酸反应又能与氢氧化钠溶液反应的氧化物是( )
| A.NaHCO3 | B.SiO2 | C.Al2O3 | D.Al(OH)3 |
下列有关硫酸和硝酸的叙述正确的是( )
| A.将浓硫酸和浓硝酸分别长期露置在空气中,浓度均会降低 |
| B.在常温下,浓硫酸和浓硝酸均能与铜剧烈反应 |
| C.稀硫酸和稀硝酸分别与金属反应时,S和N的化合物都会发生变化 |
| D.因为浓硫酸和浓硝酸都能与铁反应,所以常温下二者都不能用铁剂容器盛装 |
下列有关除去杂质(括号内为杂质)的方法和试剂都正确的是( )
| |
物质 |
方法 |
试剂 |
| A |
CO2(SO2) |
洗气 |
氢氧化钠溶液 |
| B |
氯化亚铁溶液(氯化铁) |
过滤 |
铁粉 |
| C |
水(溴) |
萃取、分液 |
酒精 |
| D |
硫酸钠(氯化铵) |
加热 |
氢氧化钠 |
有5种溶液,他们分别是:①KNO3;②BaCl2;③NaOH;④(NH4)2SO4;⑤CuCl2,若要求不用任何外加试剂鉴别它们,则鉴别的先后顺序正确的是( )
| A.⑤④①③② | B.⑤③④②① | C.②④③①⑤ | D.③②④⑤① |
下列各组离子能大量共存且溶液为无色的是( )
| A.Na+、Ag+、NO3-、Br- | B.Cu2+、SO42-、Cl-、H+ |
| C.Na+、Mg2+、SO42-、Cl- | D.Ca2+、K+、OH-、CO32- |
下列反应的离子方程式书写正确的是( )
| A.硫酸铜溶液与氢氧化钡溶液混合:Ba2++SO42-=BaSO4↓ |
| B.大理石投入稀硝酸中:CaCO3+2H+=Ca2++CO2↑+H2O |
| C.氨水与硫酸铝溶液混合:Al3++4NH3∙H2O=AlO2-+4NH4++2H2O |
D.氯水通入水中:Cl2+H2O Cl-+ClO-+2H+ Cl-+ClO-+2H+ |
下列装置能达到实验目的的是( )
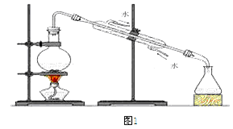
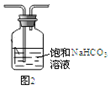


| A.图1: 制取少量纯净的水 | B.图2:除去Cl2中HCl杂质 |
| C.图3:烧瓶内形成蓝色喷泉 | D.图4:探究NaHCO3的热稳定性 |
将少量的CO2通入下列溶液中,不变浑浊的是( )
| A.偏铝酸钠溶液 | B.CaCl2溶液 | C.澄清石灰水 | D.硅酸钠溶液 |
下列物质不能通过化合反应制得的是( )
| A.SO3 | B.Na2O2 | C.Al(OH)3 | D.NO |
铝分别与足量的稀盐酸和NaOH溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗HCl和NaOH的物质的量之比为( )
| A.1:1 | B.2:1 | C.3:1 | D.4:1 |
下列各物质中,所含分子数相同的是( )
| A.10gH2和10gO2 | B.11.2LN2(标准状况)和11g CO2 |
| C.9g H2O和0.5mol Br2 | D.224mL H2(标准状况)和0.1mol N2 |
用NA表示阿伏加德罗常数的值。下列叙述正确的是( )
| A.0.5mol∙L-1K2SO4含有的K+数目为NA |
| B.56g铁与足量的盐酸反应时失去电子的数目为3NA |
| C.在标准状况下,22.4LCCl4中含有的分子数目为NA |
| D.在常温常压下,16gO2和O3的混合气体所含原子数目为NA |
向一定质量的Cu和Fe2O3的混合物中加入200mL3mol∙L-1的HCl溶液,恰好使混合物完全溶解,向所得溶液中加入KSCN溶液中,无血红色出现。若过量的CO在高温下还原此混合物,得到固体的质量为( )
| A.17.6g | B.18.4g | C.24.0g | D.条件不足无法计算 |
实验室需要200mL0.2mol∙L-1NaOH溶液。现用NaOH固体配制,可供选择的仪器有:①玻璃棒;②烧瓶;③烧杯;④胶头滴管;⑤漏斗;⑥天平;⑦药匙;⑧100mL容量瓶;⑨250mL容量瓶。回答下列问题:
(1)上述仪器中,在配制NaOH溶液时必须使用的容器除①、③、⑥、⑦外,还有_________(填数字序号)。
(2)将所配置的NaOH溶液进行测定,发现浓度小于0.2mol∙L-1。请你分析配制过程中可能引起该误差的原因是(填字母序号)_______________。
A.定容时仰视 B.移液时没有洗涤烧杯和玻璃棒 C.配制时容量瓶有少量蒸馏水
(3)将配好的溶液盛装于下列(填字母代号)______________仪器中,贴好标签备用。
A.带玻璃塞的广口瓶 B.带玻璃塞的细口瓶
C.带胶塞的广口瓶 D.带胶塞的细口瓶
某化学兴趣小组为探究SO2的化学性质,设计了如下图所示的装置进行实验。回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是________,写出圆底烧瓶发生反应的化学方程式________。
(2)E装置中干燥管的作用是____________________________。
(3)实验过程中,观察到B中的现象是_______________,原因是__________________;观察到C瓶中氯水褪色,这是因为SO2具有_______性,反应的离子方程式为__________________。
(4)用装置C还能探究SO2与品红作用的可逆性,请写出实验操作及现象__________________。
(5)充分反应后,小组同学发现铜和硫酸都有剩余,原因是___________________。若想使剩余的铜溶解,可再加入___________(填序号)。
①盐酸;②硝酸;③NaNO3固体;④K2SO4固体
碘化钾溶液久置于空气中,发生如下反应:
______KI+______O2+______H2O=______I2+______KOH
(1)在______上填上正确的化学计量数并用双线桥法标出电子转移的方向和数目;
(2)在该反应中,还原产物是________(填化学式);
(3)当有0.2mol电子发生转移时,生成I2的质量为________g。
下图所示各物质是由1~18号部分元素组成的单质或化合物,图中部分反应条件及产物未列出。已知:A、B、H的焰色反应呈黄色;A、C、D、F均为单质,物质G是使湿润的红色石蕊试纸变蓝的气体:J为白色沉淀,既能溶于B,又能溶于E。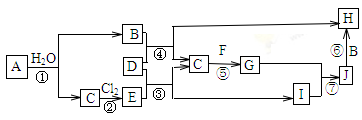
回答下列问题:
(1)写出物质G的一种用途_________________。
(2)①~⑦中属于化合反应的是______________________。
(3)按要求写出下列反应的表达式
物质I的电离方程式为_______________,反应①的离子方程式为_______________________,
反应⑥的化学方程式为______________________。
(4)向I的水溶液中滴加B溶液至过量,观察到的现象为______________________。
(1)13.2g氮的氧化物(NxO)中氧原子物质的量为0.3mol,该质量的NxO在标况下的体积为__________L,x的值为_________。
(2)化合物A的分子组成可用NxHy表示,在一定条件下可发生分解反应,15mLA气体完全分解生成5mL N2和20mL NH3(同温、同压)。A的化学式为_________________。
(3)20mL Al2(SO4)3溶液加水稀释至100mL,稀释后的溶液中SO42-的物质的量浓度为0.3mol∙L-1。则稀释前Al2(SO4)3的物质的量浓度为________________。
某厂每天产生800m3含氮的废水(NH3的含量为168mg∙L-1)。该厂处理废水的方法是:将废水加热得到NH3,使废水中NH3的含量降为15mg∙L-1(假设废水处理前后体积不变)。再对加热蒸发得到的NH3进一步处理制取硝酸。
(1)制取硝酸过程中主要发生反应如下:①_________________,②4NO+3O2+2H2O=4HNO3。反应①是氨气在一定条件下被氧气氧化,请在横线上写出该反应的化学方程式。
(2)该厂每天通过加热蒸发可得到NH3的物质的量是__________________。
(3)若在反应①中N元素损失10%,则该厂每天可生产硝酸多少吨?(写出计算过程,结果保留2位小数)
 粤公网安备 44130202000953号
粤公网安备 44130202000953号