25 ℃时,几种弱酸的电离常数如下:
| 弱酸化学式 |
CH3COOH |
HCN |
H2S |
| 电离常数(25 ℃) |
1.8 ×10-5 |
4.9 ×10-10 |
K1="1.3" ×10-7 K2="7.1" ×10-15 |
下列说法正确的是( )
A. 等物质的量浓度的各溶液pH关系为: pH(CH3COONa)>pH(Na2S)>pH(NaCN)
B. a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CN-),则a一定大于b
C. NaHS和Na2S混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c( S2-)
S2-)
D. 某浓度HCN的水溶液pH=d,则其中c(OH-)=10-d mol/L
常温下,用0.100 0 mol·L-1 NAOH溶液滴定20.00 mL 0.100 0 mol·L-1 CH3COOH溶液,所得滴定曲线如图所示.下列说法正确的是( )

| A.点①所示溶液中:C(CH3COO-)+C(OH-)=C(CH3COOH)+C(H+) |
| B.点②所示溶液中:C(NA+)=C(CH3COOH)+C(CH3COO-) |
| C.点③所示溶液中:C(NA+)>C(OH-)>C(CH3COO-)>C(H+) |
| D.滴定过程中可能出现:C(CH3COOH)>C(CH3COO-)>C(H+)>C(NA+)>C(OH-) |
80°C,0.1 mol/L NaHB溶液中c(H+)>c(OH–),可能正确的关系是
A.c(Na+)+ c(H+)= c(HB–)+ 2c(B2–) B.溶液的pH=1
C.c(H+)∙c(OH–)= 10–14 D.c(Na+)= c(H2B)+ c(HB–)
25 ℃时,关于①O.l mol·L-1的NH4Cl溶液②0.1 mol·L-1的NaOH溶液,下列叙述正确的是
| A.若向①中加适量水,溶液中c(Cl-)/c(NH4+)的值减小 |
| B.若向②中加适量水,水的电离平衡正向移动 |
| C.若将①和②均稀释100倍,①的pH变化更大 |
| D.若将①和②混合,所得溶液的pH=7,则溶液中的c(NH3·H2O)>c(Na+) |
25℃时,向10ml0.01mol/LKOH溶液中滴加0.01mol/L苯酚溶液,混合溶液中粒子浓度关系正确的
| A.pH>7时,c(C6H5O-)>c(K+)>c(H+)>c(OH-) |
| B.pH<7时,c(K+)>c(C6H5O-)>c(H+)>c(OH-) |
| C.V[C6H5OH(aq)]=10ml时,c(K+)=c(C6H5O-)>c(OH-)=c(H+) |
| D.V[C6H5OH(aq)]=20ml时,c(C6H5O-)+c(C6H5OH)=2c(K+) |
常温下,向 20 mL 0.1 mol·L-1CH3COOH溶液中滴加0.1 mol·L-1NaOH溶液。下列说法正确的是
| A.当溶液的pH=7时:c(Na+) = c(CH3COO-) + c(CH3COOH) |
| B.当加入10 mL 0.1 mol·L-1NaOH溶液时:c(CH3COO-) +2 c(OH-) = c(CH3COOH) + 2c(H+) |
| C.当加入20 mL 0.1 mol·L-1NaOH溶液时:c(Na+) >c(OH-) >c(CH3COO-) > c(H+) |
| D.滴定过程中可能有:c(CH3COOH) >c(H+) >c(CH3COO-) >c(Na+) >c(OH-) |
下列说法正确的是
A.常温下0.4 mol/L HB溶液和0. 2 mol/L NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为: c(B—)>c(H+)>c(Na+)>c(OH—)
B.常温时,pH=2的CH3COOH溶液和HCl溶液、pH=12的氨水和NaOH溶液,四种溶液中由水电离的c(H+)相等
C.常温下0.1 mol/L的下列溶液①NH4Al(SO4)2②NH4Cl③NH3·H2O④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③
D.0.1mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
下列有关电解质溶液中微粒的物质的量浓度关系正确的是 ( )
| A.在0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| B.在0.1 mol·L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3) |
| C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液:c(CO32-)> c(HCO3-)> c(OH-)>c(H+) |
| D.常温下,CH3COONa和CH3COOH混合溶液pH=7, c(Na+)=0.1 mol·L-1:c(CH3COOH) >c(Na+) >c(CH3COO-)>c(H+)=c(OH-) |
常温下将稀NaOH溶液和稀CH3COOH溶液混合,不可能出现的结果是 ( )
| A.pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-) |
| B.pH>7,且c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| C.pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
| D.pH=7,且c(CH3COO-)=c(Na+)>c(H+)=c(OH-) |
250C时,物质的量浓度相等的NaHCO3, CH3COONa混合溶液中,下列有关说法或粒子浓度关系正确的是(Ka表示CH3COOH的电离平衡常数)
A.pH可能等于7
下列有关Fe2(SO4)3溶液的叙述正确的是
| A.该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存 |
| B.和KI溶液反应的离子方程式:Fe3++2I-===Fe2++I2 |
| C.1L 0.1mol/L该溶液和足量的Zn充分反应,生成11.2 g Fe |
| D.和Ba(OH)2溶液反应的离子方程式: Fe3++SO42-+Ba2++3OH-===Fe(OH)3↓+BaSO4↓ |
常温下,把pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,在所得溶液中离子浓度大小关系正确的是( )
| A.c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | B.c(Na+)+c(H+)>c(CH3COO-)+c(OH-) |
C.c(CH3COO-)>c (Na+)>c(H+)=c(OH-) (Na+)>c(H+)=c(OH-) |
D.c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
下列有关说法正确的是( )
| A.常温下,0.1 mol/L Na2S溶液中存在:c(OH-) = c(H+) + c(HS-) + c(H2S) |
| B.常温下,pH为1的0.1 mol/L HA溶液与0.1 mol/L NaOH溶液恰好完全反应时,溶液中一定存在: c (Na+) = c(A-) > c(OH-) = c(H+) |
| C.常温下,pH=7的CH3COONa和CH3COOH混合溶液中c(Na+)="0.1" mol/L: c(Na+) = c(CH3COOH) > c(CH3COO-) > c(H+) = c(OH-) |
D.常温下,将0.1 mol/L CH3COOH溶液加水稀释,当溶液的pH从3.0升到4.0时,溶液中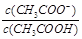 的值减小到原来的 的值减小到原来的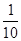 |
若往20 mL 0.01 mol·L-l HNO2(弱酸)溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如下图所示,下列有关说法不正确的是
| A.HNO2的电离平衡常数:c点>b点 |
| B.b点混合溶液显酸性:c(Na+)> c(NO2-) > c(H+)> c(OH-) |
| C.c点混合溶液中:c(OH-) > c(HNO2) |
| D.d点混合溶液中:c(Na+)> c(OH-) >c(NO2-)> c(H+) |
常温下,用 0.1000 mol·L-1NaOH溶液滴定20.00 mL0.1000 mol·L-1CH3COOH溶液所得滴定曲线如右图.
下列说法正确的是 ( )
A.点 ①所示溶液中:c(CH3COO—) +2 c(OH—) = c(CH3COOH) + 2c(H+) ①所示溶液中:c(CH3COO—) +2 c(OH—) = c(CH3COOH) + 2c(H+) |
| B.点②所示溶液中:c(Na+)<c(CH3COO—) + c(CH3COOH) |
| C.点③所示溶液中:c(Na+)>c(OH—)>c(CH3COO—)> c(H+) |
| D.滴定过程中可能出现: c(CH3COOH)>c(H+)>c(CH3COO—)>c(Na+)>c(OH—) |