下列有关电解质溶液中粒子浓度关系正确的是
| A. |
|
| B. |
含有
|
| C. |
|
| D. |
含等物质的量的
|
室温下,甲、乙两烧杯均盛有5=3的某一元酸溶液,向乙烧杯中加水稀释至
=4,关于甲、乙两烧杯中溶液的描述正确的是()
| A. |
溶液的体积:10
|
| B. |
水电离出的
|
| C. |
若分别用等浓度的
|
| D. |
若分别与5
|
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是()
| A. |
0.1
|
| B. |
0.1
|
| C. |
0.1
 c( c(
|
| D. |
0.1
|
下列关于0.10
溶液的说法正确的是()
| A. |
溶质的电离方程式为
|
| B. |
25 ℃时,加水稀释后,
|
| C. |
离子浓度关系:
|
| D. |
温度升高,
|
室温下,在0.2mol/L溶液中,逐滴加入1.0mol/L
溶液,实验测得溶液pH随
溶液体积变化曲线如下图,下列有关说法正确的是()

| A. |
a点时,溶液呈酸性的原因是
|
| B. |
a→b段,溶液pH增大,
|
| C. |
b→c段,加入的OH
-主要用于生成
|
| D. |
d点时,
|
常温下,向20.00 mL 0.100 mol·L-1CH3COONa溶液中逐滴加入0.100 mol·L-1盐酸,溶液的pH与所加入盐酸体积的关系如图所示(不考虑挥发)。下列说法正确的是
| A.点①所示溶液中:c(Na+)=c(Cl-)>c(H+)=c(OH-) |
| B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) |
| C.点③所示溶液中:c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-) |
| D.整个过程中可能出现:c(H+)+c(Na+)=c(CH3COO-)+c(CH3COOH) |
25℃时,下列各溶液中有关微粒的物质的量浓度关系正确的是
| A.在0.1 mol·L-1Na2S溶液中:2c(Na+) =c(S2-)+c(HS-) +c(H2S) |
| B.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)+ c(H+)= c(OH-)+c(CH3COO-) |
| C.向0.1 mol·L-1盐酸与0.1 mol·L-1K2CO3溶液等体积混合: c(K+) >c(Cl-)>c(HCO3-)>c(OH-)>c(H+) |
| D.向0.1 mol·L-1NH4HSO4溶液中滴加NaOH至溶液恰好呈中性: |
c(Na+)>c(NH4+)>c(SO42-)>c(OH-) =c(H+)
现有浓度均为0.1mol·L-1三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是( )
| A.溶液①中,c(CH3COO-)= c(H+) |
| B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO- ) |
| C.溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH) = c(Na+) |
| D.溶液①、③等体积混合,混合液中c(Na+)> c(CH3COO-)> c(H+)> c(OH-) |
常温下,浓度均为0.1mol/L的溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
| A.c(NH4+):③>① |
| B.水电离出的c(H+):②>① |
| C.①和②等体积混合后的溶液:c(NH4+)+c(NH3·H2O)=0.05mol/L |
| D.①和③等体积混合后的溶液pH>7:c(NH4+)>c(Cl—)>c(OH-)>c(H+) |
已知图①~④的相关信息,下列相应叙述正确的是 ( )
A.图①表示向恒容密闭容器中充入X和Y发生反应:2X(g)+Y(g)  3Z(g) △H﹤0,W点X的正反应速率等于M点X的正反应速率 3Z(g) △H﹤0,W点X的正反应速率等于M点X的正反应速率 |
B.图②表示压强对可逆反应A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强小 3C(g)+D(s)的影响,乙的压强比甲的压强小 |
| C.据图③,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至PH在4左右 |
| D.常温下,稀释0.1mol/LNa2CO3溶液,图④中的纵坐标可表示溶液中HCO3-的数目 |
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2,
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是 。
(3)吸收液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如下表:
| n(SO32﹣):n(HSO3﹣) |
99:1 |
1:1 |
1:99 |
| pH |
8.2 |
7.2 |
6.2 |
①上表判断NaHSO3溶液显 性。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母): 。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如图: 
①HSO3-在阳极放电的电极反应式是 。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理: 。
为有效控制雾霾,各地积极采取措施改善大气质量。有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要。
(1)在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质。
已知:① N2(g)+O2(g)=2NO(g) △H=+180.5kJ·mol-1
②C和CO的燃烧热(△H)分别为-393.5kJ·mol-1和-283kJ·mol-1
则2NO(g+2CO(g)=N2(g)+2CO2(g)) △H= kJ·mol-1
(2)将0.20 mol NO和0.10 mol CO充入一个容积为1L的密闭容器中,反应过程中物质浓度变化如图所示。
①CO在0-9min内的平均反应速率v(CO)=________mol (保留两位有效数字);第12 min时改变的反应条件可能为________。
(保留两位有效数字);第12 min时改变的反应条件可能为________。
| A.升高温度 | B.加入NO | C.加催化剂 | D.降低温度 |
②该反应在第24 min时达到平衡状态,CO2的体积分数为________(保留三位有效数字),化学平衡常数K=________(保留两位有效数字)。
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,该溶液中c(Na+)=________(用含硫微粒浓度的代数式表示)。
(4)通过人工光合作用能将水与燃煤产生的CO2转化成HCOOH和O2。已知常温下0.1 mol 的HCOONa溶液pH =10,则HCOOH的电离常数
的HCOONa溶液pH =10,则HCOOH的电离常数 =_________。
=_________。
已知室温下,Ka(HF)=6.8×10-4mol·L-1,Ka(CH3COOH)=1.7×10-5 mol·L-1。关于物质的量浓度均为0.1mol/L的NaF和CH3COONa混合溶液,下列说法正确的是( )
| A.c(OH-)>c(HF)>c(CH3COOH)>c(H+) | B.c(OH-)>c(F-)>c(CH3COO-)>c(H+) |
| C.c(F-)+ c(CH3COO-)="2" c(Na+) | D.c(HF)+c(CH3COOH)+ c(H+)=c(OH-) |
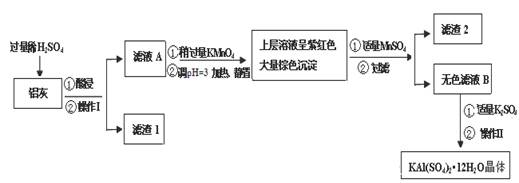
明矾[KAl(SO4)2·12H2O] 在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al 、 Al2O3及少量SiO2和FeO ·xFe2O3)可制备明矾。工艺流程如下:
回答下列问题:
(1)明矾净水的原理是(用离子方程表示)
(2)操作Ⅰ是 ,操作Ⅱ是蒸发浓缩、 、过滤、 干燥。
(3)检验滤液A中是否存在Fe2+的方法是 (只用一种试剂)
(4)在滤液A中加入高锰酸钾的目的是 ,发生反应的离子方程式为(该条件下Fe2+转化为Fe3+,MnO4- 转化为Mn2+) 。
已知:生成氢氧化物沉淀的pH如下表所示
| |
Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
注:金属离子的起始浓度为0.1 mol·L-1
根据表中数据解释调pH=3的目的 。
(5)己知:在pH=3、加热条件下,MnO4- 可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为: 。滤渣2含有的物质是 。
(6)以Al和NiO(OH)为电极,KOH溶液为电解液可组成新型、高效电池,充放电过程中,发生Ni(OH)2与NiO(OH)之间的转化,写出放电时电池反应的化学方程式 。