广东肇庆市高中毕业班第二次模拟考试理综化学试卷
下列有关物质的性质和应用正确的是( )
| A.福尔马林可用于保存海鲜产品 |
| B.油脂在酸性条件下可水解生成高级脂肪酸和甘油 |
| C.乙醇、糖类和蛋白质都是人体必需的营养物质 |
| D.合成橡胶与光导纤维都属于有机高分子材料 |
下列说法正确的是( )
| A.二氧化硫具有较强的还原性,故不能用浓硫酸干燥 |
| B.含极性键的共价化合物一定是电解质 |
| C.氯化钠、冰醋酸、酒精分别属于强电解质、弱电解质、非电解质 |
| D.天然气、酒精和液化石油气分别属于化石能源、不可再生能源和二次能源 |
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.在pH=1的溶液中:K+、Na+、SO42–、HCO |
B.在0.1 mol·L-1 Na2CO3溶液中:Al3+、K+、NO 、SO42– 、SO42– |
C.在0.1 mol·L-1 FeCl3溶液中:K+、NH 、I-、SCN- 、I-、SCN- |
D.在c( H+)/c(OH-)=10-12的溶液中:K+、Na+、ClO-、NO |
下列陈述和判断均正确,且有因果关系的是( )
| 选项 |
陈述 |
判断 |
| A |
Si有良好的半导体性能 |
Si可用于制备光导纤维 |
| B |
在未知溶液中加入稀硝酸和氯化钡溶液有沉淀生成 |
说明该未知溶液含有SO42- |
| C |
铁、铜、汞、银的金属活动性顺序为Fe>(H)>Cu>Hg>Ag |
要从矿石中冶炼得到金属单质,铁和铜必须用还原剂,汞和银只需加热 |
| D |
锌锰干电池碳棒是正极,MnO2是氧化剂 |
锌锰干电池是二次电池,可以反复充电 |
现有浓度均为0.1mol·L-1三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是( )
| A.溶液①中,c(CH3COO-)= c(H+) |
| B.溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO- ) |
| C.溶液①、②等体积混合,混合液中c(CH3COO-)+c(CH3COOH) = c(Na+) |
| D.溶液①、③等体积混合,混合液中c(Na+)> c(CH3COO-)> c(H+)> c(OH-) |
设NA为阿伏加德罗常数的值。下列说法正确的是( )
| A.25℃时,pH=13的氨水中含有OH-的数目为0.1NA |
| B.1 mol Na被完全氧化生成Na2O2,转移电子的数目为NA |
| C.标准状况下,2.24 LNO2与水反应生成NO3-的数目为0.1NA |
| D.4.0 g H2与足量N2完全反应生成NH3,反应中断裂共价键的总数为2NA |
下列离子方程式正确的是( )
| A.过氧化钠和水反应:2Na2O2+2H2O=4Na++4 OH—+O2↑ |
| B.用铜为电极电解饱和食盐水:2Cl—+2H2O通电Cl2↑+H2↑+2OH— |
| C.在明矾溶液中滴加过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+ |
| D.向小苏打溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O |
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色。Q元素的原子最外层电子数是其内层电子数的2倍。W、Z最外层电子数相同,Z的核电荷数是W的2倍。元素Y的合金是日常生活中使用广泛的金属材料之一,下列说法正确的是( )
| A.氢化物稳定性:Z>W |
| B.原子半径的大小顺序:rX>rY>rQ>rW |
| C.元素Q和Z能形成QZ2型的共价化合物 |
| D.X、Y的最高价氧化物的水化物之间不能发生反应 |
.药物Z可用于治疗哮喘、系统性红斑狼疮等,可由X(1,4-环己二酮单乙二醇缩酮)和Y(咖啡酸)为原料合成,如下图:
(1)化合物X的有 种化学环境不同的氢原子。
(2)下列说法正确的是 。
| A.X是芳香化合物 | B.Ni催化下Y能与5molH2加成 |
| C.Z能发生加成、取代及消去反应 | D.1mol Z最多可与5mol NaOH反应 |
(3)Y与过量的溴水反应的化学方程式为 。
(4)X可以由 (写名称)和M(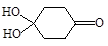 )分子间脱水而得;一定条件下,M发生1个—OH的消去反应得到稳定化合物N(分子式为C6H8O2),则N的结构简式为 (已知烯醇式不稳定,会发生分子重排,例如:
)分子间脱水而得;一定条件下,M发生1个—OH的消去反应得到稳定化合物N(分子式为C6H8O2),则N的结构简式为 (已知烯醇式不稳定,会发生分子重排,例如: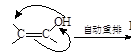
 )。
)。
(5)Y也可以与环氧丙烷(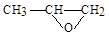 )发生类似反应①的反应,其生成物的结构简式为 (写一种);Y的同分异构体很多种,其中有苯环、苯环上有三个取代基(且酚羟基的位置和数目都不变)、属于酯的同分异构体有 种。
)发生类似反应①的反应,其生成物的结构简式为 (写一种);Y的同分异构体很多种,其中有苯环、苯环上有三个取代基(且酚羟基的位置和数目都不变)、属于酯的同分异构体有 种。
.减少污染、保护环境是全世界最热门的课题。
(1)为了减少空气中SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。
已知:H2(g)+1/2O2(g)==H2O(g) ΔH1=-241.8 kJ·mol-1
C(s)+1/2O2(g)===CO(g) ΔH2=-110.5 kJ·mol-1
则焦炭与水蒸气反应生成CO的热化学方程式为 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是 (填序号):
a.Ca(OH)2 b.CaCl2 c.Na2CO3 d.NaHSO3
(2)CO在催化剂作用下可以与H2反应生成甲醇:CO(g)+2H2(g)  CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。
CH3OH(g)。在密闭容器中充有10 mol CO与20 mol H2,CO的平衡转化率与温度、压强的关系如右图所示。
①M、N两点平衡状态下,容器中总物质的物质的量之比为:n(M)总:n(N)总= 。
②若M、N、Q三点的平衡常数KM、KN、KQ的大小关系为 。
(3)催化硝化法和电化学降解法可用于治理水中硝酸盐的污染。
①催化硝化法中,用H2将NO 还原为N2,一段时间后,溶液的碱性
还原为N2,一段时间后,溶液的碱性
明显增强。则该反应离子方程式为 。
②电化学降解NO 的原理如图所示,电源正极为 (填“a”或“b”);
的原理如图所示,电源正极为 (填“a”或“b”);
若总反应为4NO3-+4H+通电5O2↑+2N2↑+2H2O,则阴极反应式为 。
.欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去。三种金属离子生成沉淀的pH如表。
| |
开始沉淀的pH |
完全沉淀的pH |
| Fe(OH)2 |
7.0 |
9.0 |
| Fe(OH)3 |
1.9 |
3.2 |
| Cr(OH)3 |
6.0 |
8.0 |
(1)某含铬废水处理的主要流程如下图所示: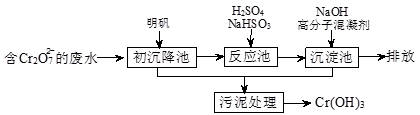
①初沉池中加入明矾作沉降剂,其作用的原理是(用离子方程式表示) 。
②请补充并配平以下反应池中发生主要反应的离子方程式:
Cr2O72-+ HSO3-+ == Cr3++ SO42-+ H2O。
③根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子方程式是:H++OH-=H2O和 。证明Cr3+沉淀完全的方法是 。
(2)工业可用电解法来处理含Cr2O72-废水。实验室利用如图模拟处理含Cr2O72-的废水,阳极反应是Fe-2e-=Fe2+,阴极反应式是2H++2e-=H2↑。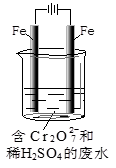
①Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是 ,
②上述反应得到的金属阳离子在阴极区可沉淀完全,从其对水的电离平衡角度解释其原因
。
③若溶液中含有0.01mol Cr2O72-,则阳离子全部生成沉淀的物质的量是_______mol。
.化学实验是科学探究的基础。请回答有关实验问题:
(1)下面的四个实验装置有三个都存在明显缺陷,其中完全正确的是 :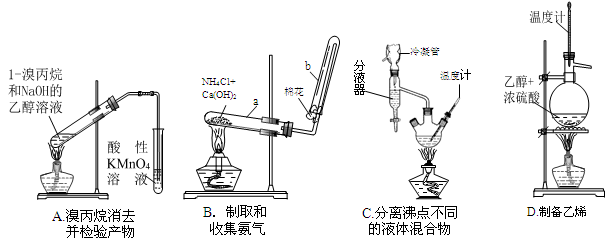
(2)要检验上面B装置氨气已集满的操作是 则试管已集满。
(3)ClO2是一种安全、高效、广谱、强力杀菌剂,其性质如右表:
①由下表可以看出:保存液态ClO2的条件是密封、 ;ClO2与碱反应的离子方程式 ;观察下“图A”,要从NaClO2溶液制得不含结晶水的晶体,操作是蒸发结晶,控制条件是 ;应控制析出晶体的温度范围是 。
| 色态 |
溶于碱 |
超过1Kpa、受热或遇光 |
|
| 常温气体 |
-59-11℃ 红黄色液体 |
生成亚氯酸盐和氯酸盐 |
爆炸 |
②工业用潮湿的KClO3和草酸(H2C2O4)在60℃时反应制得。某学生拟用下图B所示装置模拟工业制法制取并收集液态ClO2,请模仿下图B的装置图和图例,在答题卡的相应图中补充完善装置图,并作必要的标注。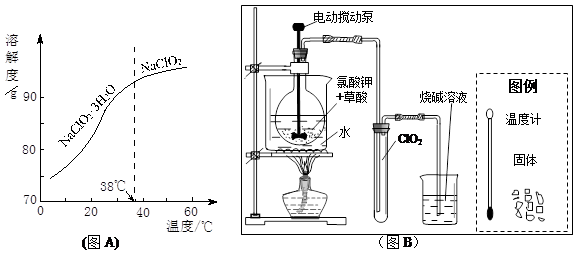
 粤公网安备 44130202000953号
粤公网安备 44130202000953号