全国普通高等学校招生统一考试理科综合能力测试化学
水是生命之源,2014年我国科学家首次拍摄到水分子团簇的空间取向图像,模型如图。下列关于水的说法正确的是

| A. | 水是弱电解质 | B. | 可燃冰是可以燃烧的水 |
| C. | 氢氧两种元素只能组成水 | D. | 0℃时冰的密度比液态水的密度大 |
下列关于化学用语的表示正确的是
| A. |
过氧化钠的电子式:

|
| B. | 质子数为35、中子数为45的溴原子: |
| C. |
硫离子的结构示意图:

|
| D. |
间二甲苯的结构简式:

|
25时,下列各组离子在指定溶液中一定能大量共存的是
| A. | =1的溶液中: 、 、 、 |
| B. | =1×10 -13的溶液中: 、 、 、 |
| C. | 0.1 溶液中: 、 、 、 |
| D. | 0.1 溶液中: 、 、 、 |
下列物质性质与应用对应关系正确的是
| A. | 晶体硅熔点高硬度大,可用于制作半导体材料 |
| B. | 氢氧化铝具有弱碱性,可用于制胃酸中和剂 |
| C. | 漂白粉在空气中不稳定,可用于漂白纸张 |
| D. | 氧化铁能与酸反应,可用于制作红色涂料 |
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是()

| A. | 用装置甲制取氯气 |
| B. | 用装置乙除去氯气中的少量氯化氢 |
| C. | 用装置丙分离二氧化锰和氯化锰溶液 |
| D. | 用装置丁蒸干氯化锰溶液制 |
设为阿伏伽德罗常数的值。下列说法正确的是
| A. | 1.6 由氧气和臭氧组成的混合物中含有氧原子的数目为0.1 |
| B. | 0.1 丙烯酸中含有双键的数目为0.1 |
| C. | 标准状况下,11.2 苯中含有分子的数目为0.5 |
| D. | 在过氧化钠与水的反应中,每生成0.1 氧气,转移电子的数目为0.4 |
下列指定反应的离子方程式正确的是()
| A. | 溶于稀硝酸 : + ++ -= 2 ++ ↑+ |
| B. | 溶液与过量 溶液反应制 : 2 ++ -= ↓ |
| C. | 用 溶解 : + + 2 ++ + ↑ |
| D. | 向 溶液中通入过量 制 : + -+ = ↓+ - |
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是
 物质 物质组别 |
甲 |
乙 |
丙 |
||||
| A |
|
|
|
||||
| B |
|
O2 |
|
||||
| C |
|
|
|
||||
| D |
|
|
|
短周期主族元素、、、的原子序数依次增大。原子的最外层电子数是其内层电子数的2倍,是地壳中含量最高的元素,
2+与2-具有相同的电子层结构,与同主族。下列说法正确的是()
| A. | 原子半径大小顺序: |
| B. | 分别与 , 形成的化合物中化学键类型相同 |
| C. | 的最高价氧化物对应水化物的酸性比 的弱 |
| D. | 的气态简单氢化物的热稳定性比 的强 |
已知:
下列关于上述反应焓变的判断正确的是
| A. | >0, <0 |
| B. | >0, >0 |
| C. | = + |
| D. | = + |
下列有关说法正确的是()
| A. | 若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀 |
| B. | 在常温下能自发进行,则该反应的 |
| C. | 加热0.1 溶液, 的水解程度和溶液的pH均增大 |
| D. | 对于乙酸与乙醇的酯化反应( ),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 |
去甲肾上腺素可以调控动物机体的植物性神经功能,其结构简式如图所示。下列说法正确的是

| A. | 每个去甲肾上腺素分子中含有3个酚羟基 |
| B. | 每个去甲肾上腺素分子中含有1个手性碳原子 |
| C. | 1 去甲肾上腺素最多能与2 发生取代反应 |
| D. | 去甲肾上腺素既能与盐酸反应,又能与氢氧化钠溶液反应 |
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是
| A. | 氯水的颜色呈浅绿色,说明氯水中含有 |
| B. | 向氯水中滴加硝酸酸化的 溶液,产生白色沉淀,说明氯水中含有 |
| C. | 向氯水中加入 粉末,有气泡产生,说明氯水中含有 |
| D. | 向 溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有 |
25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是()
| A. | 0.1 与0.1 溶液等体积混合:c( )=c( )>c( )>c( ) |
| B. | 0.1 与0.1 氨水等体积混合(pH>7):c( · )>c( )>c( )>c( ) |
| C. |
0.1
与0.1
溶液等体积混合:
 c(
)=c(
)+c(
)+c(
) c(
)=c(
)+c(
)+c(
)
|
| D. | 0.1 与0.1 溶液等体积混合( 为二元弱酸):2c( )+c( )+c( )=c( )+c( ) |
一定温度下,在三个体积约为1.0的恒容密闭容器中发生反应:2 +
+
| 容器 编号 |
温度() |
起始物质的量() |
平衡物质的量() |
|
| I |
387 |
0.20 |
0.080 |
0.080 |
| Ⅱ |
387 |
0.40 |
||
| Ⅲ |
207 |
0.20 |
0.090 |
0.090 |
下列说法正确的是
该反应的正方应为放热反应
达到平衡时,容器I中的体积分数比容器Ⅱ中的小
容器I中反应达到平衡所需时间比容器Ⅲ中的长
若起始时向容器I中充入 0.1、 0.15和 0.10,则反应将向正反应方向进行
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含、等)制备碱式硫酸铝溶液,并用于烟气脱硫研究。

(1)酸浸时反应的化学方程式为;滤渣Ⅰ的主要成分为(填化学式)。
(2)加调节溶液的至3.6,其目的是中和溶液中的酸,并使转化为。滤渣Ⅱ的主要成分为(填化学式);若溶液的偏高,将会导致溶液中铝元素的含量降低,其原因是(用离子方程式表示)。
(3)上述流程中经完全热分解放出的量总是小于吸收的量,其主要原因是;与吸收前的溶液相比,热分解后循环利用的溶液的将(填"增大"、"减小"或"不变")。
非诺洛芬是一种治疗类风湿性关节炎的药物,可通过以下方法合成:

请回答下列问题:
(1)非诺洛芬中的含氧官能团为和(填名称)。
(2)反应①中加入的试剂的分子式为,的结构简式为 (3)在上述五步反应中,属于取代反应的是(填序号)。
(4)的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与溶液发生显色反应。
Ⅱ.分子中有6种不同化学环境的氢,且分子中含有两个苯环。
写出该同分异构体的结构简式:
(5)根据已有知识并结合相关信息,写出以 为原料制备
为原料制备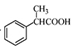 的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
碱式碳酸铝镁常用作塑料阻燃剂。
(1)碱式碳酸铝镁具有阻燃作用,是由于其受热分解需吸收大量热量和
(2)中、、、的代数关系式为
(3)为确定碱式碳酸铝镁的组成,进行如下实验:
①准确称取3.390样品与足量稀盐酸充分反应,生成0.560(已换算成标准状况下)。
②另取一定量样品在空气中加热,样品的固体残留率(固体样品的剩余质量/固体样品的起始质量×100%)随温度的变化如右图所示(样品在270C时已完全失去结晶水,600以上残留固体为金属氧化物的混合物)。
根据以上实验数据计算碱式碳酸铝镁样品中的: (写出计算过程)。

实验室从含碘废液(除外,含有、、等)中回收碘,其实验过程如下:

(1)向含碘废液中加入稍过量的溶液,将废液中的还原为,其离子方程式为
(2)操作X的名称为
(3)氧化时,在三颈烧瓶中将含的水溶液用盐酸调至pH约为2,缓慢通入,在400C左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是

(4)已知:某含碘废水(pH约为8)中一定存在,可能存在、中的一种或两种。请补充完整检验含碘废水中是否含有、的实验方案:取适量含碘废水用多次萃取、分液,直到水层用淀粉溶液检验不出碘单质存在;
。
实验中可供选择的试剂:稀盐酸、淀粉溶液、溶液、溶液
硫化氢的转化是资源利用和环境保护的重要研究课题。由硫化氢获得硫单质有多种方法。
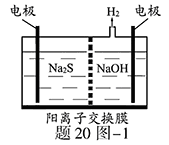
(1)将烧碱吸收后的溶液加入到如题20图-1所示的电解池的阳极区进行电解。电解过程中阳极区发生如下反应: ①写出电解时阴极的电极反应式:。
②电解后阳极区的溶液用稀硫酸酸化得到硫单质,其离子方程式可写成。
(2)将和空气的混合气体通入、、的混合溶液中反应回收,其物质转化如题20图-2所示。
①在图示的转化中,化合价不变的元素是。
②反应中当有1转化为硫单质时,保持溶液中的物质的量不变,需要消耗的物质的量为。
③在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含,可采取的措施有。
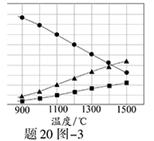
(3)在高温下分解生成硫蒸气和。若反应在不同温度下达到平衡时,混合气体中各组分的体积分数如题20图-3所示,在高温下分解反应的化学方程式为。

[物质结构与性质]
含有的悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米。
(1)+基态核外电子排布式为
(2)与-互为等电子体的一种分子为 (填化学式)。
(3)醛基中碳原子的轨道杂化类型是 ;乙醛分子中含有的键的数目为 。
(4)含有的悬浊液与乙醛反应的化学方程式为 。
(5)在稀硫酸中生成和。铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为 。

磷酸铁(,难溶于水的米白色固体)可用于生成药物、食品添加剂和锂离子电池的正极材料,实验室可通过下列实验制备磷酸铁。
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤,反应加热的目的是。
(2)向滤液中加入一定量氧化。为确定加入的量,需先用标准溶液滴定滤液中的,离子方程式如下:

①在向滴定管注入K2Cr2O7标准溶液前,滴定管需要检漏、和。
②若滴定x滤液中的,消耗a 标准溶液b,则滤液中
=
③为使滤液中的完全被氧化,下列实验条件控制正确的是(填序号)。
| A. | 加入适当过量的 溶液 | B. | 缓慢滴加 溶液并搅拌 |
| C. | 加热,使反应在较高温度下进行 | D. | 用氨水调节 =7 |
(3)将一定量的溶液(溶液显碱性)加入到含有的溶液中,搅拌、过滤、洗涤、干燥得到 。若反应得到的固体呈棕黄色,则磷酸铁中混有的杂质可能为。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号