磷酸铁(,难溶于水的米白色固体)可用于生成药物、食品添加剂和锂离子电池的正极材料,实验室可通过下列实验制备磷酸铁。
(1)称取一定量已除去油污的废铁屑,加入稍过量的稀硫酸,加热、搅拌,反应一段时间后过滤,反应加热的目的是。
(2)向滤液中加入一定量氧化。为确定加入的量,需先用标准溶液滴定滤液中的,离子方程式如下:

①在向滴定管注入K2Cr2O7标准溶液前,滴定管需要检漏、和。
②若滴定x滤液中的,消耗a 标准溶液b,则滤液中
=
③为使滤液中的完全被氧化,下列实验条件控制正确的是(填序号)。
| A. | 加入适当过量的 溶液 | B. | 缓慢滴加 溶液并搅拌 |
| C. | 加热,使反应在较高温度下进行 | D. | 用氨水调节 =7 |
(3)将一定量的溶液(溶液显碱性)加入到含有的溶液中,搅拌、过滤、洗涤、干燥得到 。若反应得到的固体呈棕黄色,则磷酸铁中混有的杂质可能为。
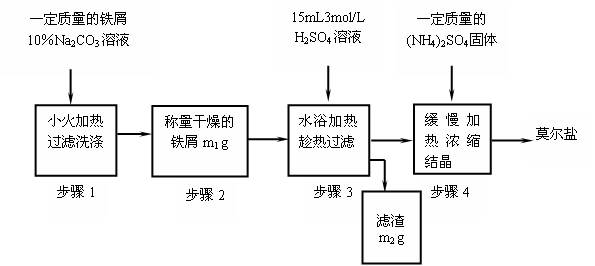
 测定剩余固体质量
测定剩余固体质量

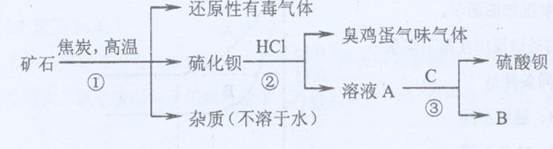 (1)写出步骤①的化学反应方程式,该反应产生的气体具有、等用途。
(1)写出步骤①的化学反应方程式,该反应产生的气体具有、等用途。
 8H20晶体和NH4Cl晶体反应过程中的能量变化⑤用蒸馏法分离两种沸点差距较大的液体⑥过滤分离互不相溶的固体和液体⑦用已知浓度的盐酸滴定待测浓度的NaOH溶液的酸碱中和滴定过程⑧稀释浓H2SO4的过程
8H20晶体和NH4Cl晶体反应过程中的能量变化⑤用蒸馏法分离两种沸点差距较大的液体⑥过滤分离互不相溶的固体和液体⑦用已知浓度的盐酸滴定待测浓度的NaOH溶液的酸碱中和滴定过程⑧稀释浓H2SO4的过程
 粤公网安备 44130202000953号
粤公网安备 44130202000953号