[物质结构与性质]
含有的悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米。
(1)+基态核外电子排布式为
(2)与-互为等电子体的一种分子为 (填化学式)。
(3)醛基中碳原子的轨道杂化类型是 ;乙醛分子中含有的键的数目为 。
(4)含有的悬浊液与乙醛反应的化学方程式为 。
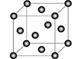
(5)在稀硫酸中生成和。铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为 。
[物质结构与性质]
含有的悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米。
(1)+基态核外电子排布式为
(2)与-互为等电子体的一种分子为 (填化学式)。
(3)醛基中碳原子的轨道杂化类型是 ;乙醛分子中含有的键的数目为 。
(4)含有的悬浊液与乙醛反应的化学方程式为 。
(5)在稀硫酸中生成和。铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为 。
