常温下,下列各溶液的叙述中正确的是
| A.NaHSO3与Na2SO3混合溶液中:3c(Na+)=c(HSO3-)+c(SO32-) |
| B.0.1 mol/L的醋酸钠溶液20 mL与0.1 mol/L盐酸10 mL混合后溶液显酸性:c(CH3COO-)>c(CH3COOH) >c(Cl-)>c(H+) |
| C.等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| D.向1.00 L 0.3 mol/LNaOH溶液中缓慢通入0.2 mol CO2气体,溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
25℃时,下列有关电解质溶液中微粒的物质的量浓度关系正确的是
| A.在0.1mol•L-1 NaHCO3溶液中:c(HCO3-)>c(Na+)>c(CO32-)>c(H2CO3) |
| B.pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| C.在0.1 mol•L-1Na2CO3溶液中:c(OH-)=c(HCO3-)+2c(H2CO3)+c(H+) |
| D.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) |
下列有关电解质溶液的说法正确的是
| A.在Na2S稀溶液中:c (Na+)>c (S2-)>c (OH-)>c (H+)>c (HS-) |
| B.在Na2C2O4稀溶液中:c (Na+)+c (H+)=" c" (OH-)+c (C2O42-)+c (HC2O4-) |
| C.在含等物质的量的Na2CO3和NaHCO3的混合溶液中: 3 c (Na+)="2[c" (CO32-)+ c (HCO3-)+ c (H2CO3)] |
| D.在NaHSO3稀溶液中:c (OH-)+c (SO32-)=" c" (H+)+c (H2SO3) |
下列说法正确的是
| A.1L 1 mol/L的盐酸中所含微粒总数约为2×6.02×1023个 |
B.NaHS溶液中HS-的水解方程式为:HS-+H2O S2-+H3O+ S2-+H3O+ |
| C.A(s)=B(s)+C(g) ΔH=+86 kJ/mol能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
| D.由水电离出的c(H+)=10-13mol/L的溶液中可能含有:Fe2+、K+、CO32-、NO3- |
下列溶液中有关微粒的物质的量浓度关系正确的是
| A.等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)=c(SO42-)>c(NH4+)>c(OH-)>c(H+) |
| B.常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>c(CH3COOH)=c(Cl-) |
| C.物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-) |
| D.pH=1的NaHSO4溶液:c(H+)=2c(SO42-)+c(OH-) |
根据下表提供的数据,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是
| 化学式 |
电离常数 |
| HClO |
Ka=3×10-8mol·L-1 |
| H2CO3 |
Ka1=4.3×10-7mol·L-1 |
| Ka2=5.6×10-11mol·L-1 |
A.c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)
B.c(HCO3-)>c(ClO-)>c(OH-)
C.c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)
D.c(ClO-)>c(HCO3-)>c(H+)
常温下,下列溶液中有关物质的量浓度关系不正确的是
A.pH=2的HA溶液与pH=12的MOH溶液等体积混合后pH<7,则HA为弱酸
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa)
C.物质的量浓度均为0.2mol·L-1CH3COOH和CH3COONa溶液等体积混合:2c(Na+) =c(CH3COO-) + c(CH3COOH)=0.2mol·L-1
D.0.1mol·L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)
关于离子浓度的关系,下列说法错误的是
A.等浓度的 、 、 混合溶液中: 混合溶液中:  |
B.新制氯水中: |
C.室温下,向0.01  溶液中滴加 溶液中滴加 溶液至中性: 溶液至中性: |
D.物质的量浓度均为 的 的 和 和 混合溶液中,离子浓度可能的关系为: 混合溶液中,离子浓度可能的关系为: |

常温下,用 0.1mol·L—1HCl溶液滴定10.0 mL浓度为0.1 mol·L—1 Na2CO3溶液,所得滴定曲线如右图所示。下列说法正确的是
| A.当V=0时:c(H+)+c(HCO3-)+c(H2CO3)=c(OH-) |
| B.当V=5时:c(CO32—)+c(HCO 3-)+c(H2CO3)=2c(Cl-) |
| C.当V=10时:c(Na+)>c(HCO 3-)>c(CO32—)>c(H2CO3) |
| D.当V=a时:c(Na+)>c(Cl-)>c(H+)=c(OH-) |
常温下,下列有关电解质溶液中相关微粒的物质的量浓度关系不正确的是
| A.0.1moI·L-lCH3COOH溶液中:c(CH3COO-)< c(H+) |
| B.0.1moI·L-lNH4Cl溶液中:c(NH4+)+c(H+)= c(Cl-)+c(OH-) |
| C.0.1moI·L-lNa2CO3溶液与0.1moI·L-lNaHCO3溶液等体积混合后的溶液中:c(HCO3-)+2c(CO32-)+c(H2CO3)=0.1moI·L-l |
| D.浓度均为0.1 moI·L-l的NH4C1、CH3COONH4、NH4HSO4溶液中,c(NH4+)的大小顺序为:CH3COONH4>NH4Cl>NH4HSO4 |
(1)与明矾相似,硫酸铁也可用作净水剂,其原理为_________(用离子方程式表示)。
(2)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为___________________。
(3)已知:S2O32—有较强的还原性,实验室可用I-测定K2S2O8样品的纯度,反应方程式为S2O82—+2I-=2SO42—+I2①、I2+2S2O32-=2I-+S4O62—②。S2O82—、S4O62—、I2氧化性强弱顺序:__________。
(4)已知溶液中,还原性为HSO3—>I-,氧化性为IO3—>I2>SO42—。在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示。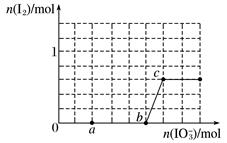
a点处的还原产物是__________(填离子符号);
b点→c点反应的离子方程式是__________________。
下列关于电解质溶液中离子浓度关系的说法正确的是
| A.0.1mol/L的NaHCO3溶液中离子浓度的关系:c(Na+)=c(HCO3-) + c(H2CO3) + 2c(CO32-) |
| B.0.1mol/L的NH4Cl溶液和0.1mol/L的NH3·H2O等体积混合后离子浓度的关系:c( Cl-)>c(NH4+)>c(H+)>c (OH-) |
| C.常温下,向醋酸钠溶液中滴加少量醋酸使溶液的pH=7,则混合溶液中:c(Na+)=c(CH3COO-) |
| D.KHS溶液中存在等式关系:2c(S2-) + c(OH-) = c(H+) + c(H2S) |
常温下,下列溶液中的粒子浓度关系正确的是
| A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) |
| B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
C.25℃时,浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液pH=4.75, |
| D.一定物质的量浓度的Na2S溶液中:c(OH-) =c(H+)+2c(H2S) + c(HS-) |
常温下,在25mL 0.1 mol·L-1 NaOH溶液中逐滴加入a mL 0.2 mol·L-1 CH3COOH溶液,有关混合溶液的判断正确的是
| A.当pH=7时,一定有:c(Na+)=c(CH3COO-)=c(OH-)=c(H+) |
| B.当a=25时,一定有:c(CH3COO-)+c(CH3COOH)=c(Na+) |
| C.当c(CH3COO-)>c(Na+)时,a一定大于12.5 |
| D.当c(OH-)>c(H+)时,a一定小于12.5 |
如图为常温下,向25 mL某浓度的 NaOH溶液中逐滴加入0.2 mol·L-1 CH3COOH溶液的过程中溶液pH的变化曲线。下列说法不正确的是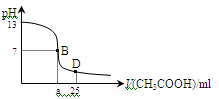
| A.NaOH溶液起始浓度为0. 1 mol·L-1 |
| B.a>12.5 |
| C.B点溶液中c(Na+)一定等于c(CH3COO-) |
| D.D点溶液中: c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |