请完成下列各空:
(1) pH= a的CH3COOH溶液稀释100倍后所得溶液pH a +2(填“>”或“<”下同)
(2)0.1 mol·L-1CH3COONa溶液的pH 7
已知二元酸H2A在水中存在以下电离:H2A===H++HA-, HA- H++A2-,试回答下列问题:
H++A2-,试回答下列问题:
(1)NaHA溶液呈________性,理由是 .
(2)某温度下,向10 mL、0.1 mol/L NaHA溶液中加入0.1 m ol/L KOH溶液V mL至中性,此时溶液中以下关系一定正确的是________(填写字母).
ol/L KOH溶液V mL至中性,此时溶液中以下关系一定正确的是________(填写字母).
| A.溶液pH=7 | B.水的离子积KW=c2(OH-) | C.V=10 | D.c(K+)<c( Na+) Na+) |
(3)已知难溶物CaA在水中存在溶解平衡;CaA(s)  Ca2++A2-;ΔH>0,一定温度下CaA饱和溶液中c(Ca2+)·c(A2-)为常数,记作Ksp=c(Ca2+)·c(A2-),Ksp只与温度有关.
Ca2++A2-;ΔH>0,一定温度下CaA饱和溶液中c(Ca2+)·c(A2-)为常数,记作Ksp=c(Ca2+)·c(A2-),Ksp只与温度有关.
①温度升高时,Ksp________(填“增大”、“减小”或“不变”,下同).
②向浊液中通入HCl气体,c(Ca2+)________,原因是 .
(4)测得25℃时,CaA的Ksp为2.0×10-11,常温下将10 g CaA固体投入100 mL CaCl2溶液中,充分搅拌后仍有固体剩余,测得溶液中c(Ca2+)=0.1 mol/L,则溶液中c(A2+)= ____________mol/L
常温下,取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8。试回答以下问题:
(1)混合后溶液的pH=8的原因是____________________________(用离子方程式表示)。
(2)混合后的溶液中由水电离出的c(OH-)____0.1 mol/L NaOH溶液中由水电离出的c(OH-) (填“>”、“<”或“=”)。
(3)已知NH4A溶液为中性,又知将HA溶液加到NaHCO3溶液中有气体放出,试推断NH4HCO3溶液的pH________7(填“>”、“<”或“=”)。
(4)有相同温度下相同浓度的四种盐溶液:
| A.NH4HCO3; | B.NH4A; | C.(NH4)2SO4; | D.NH4Cl,按pH由大到小的顺序排列_______(填序号)。 |
A、B、C三种物质都是H、N、O、Na中的任意三种元素组成的强电解质,A的水溶液呈中性,B的水溶液呈碱性,C的水溶液呈酸性,请找出B、C可能的两种组合,要求B1溶液中水的电离程度小于B2溶液中水的电离程度,C1溶液中水的电离程度小于C2溶液中水的电离程度。(已知0.1mol/LHNO2溶液pH>1)
(1)写出化学式: A____________ B1____________ B2____________
(2)25℃时,B1溶液中水电离出的OH—的物质的量浓度_______10—7mol/L
(填>、<、=)
(3)25℃时,当B1、C1两稀溶液的物质的量浓度相等时,两溶液的pH值之和_____14(填>、<、=、≥、≤)。
(4)25℃时,pH=a(3<a<5)的C1、C2两溶液中水电离出的H+的物质的量浓度比值为 。 (用含a的代数式表示)
(10分)取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8。试回答以下问题:
(1)混合溶液的pH=8的原因是_____________________________________________
_________________________________________________(用离子方程式表示)。
(2)混合溶液中由水电离出的c(H+)________0.1 mol/L NaOH溶液中由水电离出的c(H+) (填“>”、“<”或“=”)。
(3)求出混合液中下列算式的精确计算结果(填具体数字):
c(Na+)-c(A-)=________mol/L;c(OH-)-c(HA)=________mol/L。
(4)已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH________7(填“>”、“<”或“=”)。
(10分)金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度(s,mol·L-1)见右图。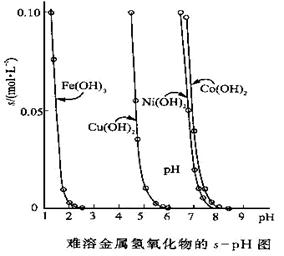
(1)pH=3时溶液中铜元素的主要存在形式是:________(化学式)
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,___ (能、不能)通过调节溶液pH的方法来除去,理由是_________。
(4)已知一些难溶物的溶度积常数如下表。
| 物质 |
FeS |
MnS |
CuS |
PbS |
HgS |
ZnS |
| Ksp |
6.3×10-18 |
2.5×10-13 |
1.3×10-36 |
3.4×10-28 |
6.4×10-53 |
1.6×10-24 |
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的_______除去它们。
A.NaOH B.FeS C.Na2S
(1)室温下,在pH=12的某种溶液中,由水电离的c(OH-)为____________。
(2)等体积的下列溶液中,阳离子的总物质的量最大的是____________。
①0.2 mol·L-1的CuSO4溶液
②0.1 mol·L-1的Na2CO3
③0.2 mol·L-1的KCl
④0.1 mol·L-1的Na2SO4
(3)浓度为0.100 mol·L-1的下列各物质的溶液中,c(NH4+)由大到小的顺序是_________________(填序号)。
①NH4Cl ②NH4HSO4 ③NH3·H2O ④CH3COONH4
(4)某二元酸(化学式用H2A表示)在水中的电离方程式是:
H2A====H++HA-, HA- H++A2- 。
H++A2- 。
①则Na2A溶液显__________________(填“酸性”“中性”或“碱性”),理由是_______________________________(用离子方程式表示)。
②若有0.1 mol·L-1 Na2A的溶液,其中各种离子浓度由大到小的顺序是: (填序号)。
| A.c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+) |
| B.c(Na+)>c(OH-)>c(HA-)>c(A2-)>c(H+) |
| C.c(Na+)>c(H+)>c(A2-)>c(OH-)>c(HA-) |
| D.c(A2-)>c(Na+)>c(OH-)>c(H+)>c(HA-) |
(8分)在25℃时,有pH为a的HCl溶液和pH为b的NaOH溶液,取VaL该盐酸溶液用该NaOH溶液中和,需VbLNaOH溶液,(题中 a < b, b ≥ 8)。问:
(1)若a+b=14,则Va/Vb= .
(2)若a+b=13,则Va/Vb=
(3)若a+b>14,则Va/Vb= ,且Va Vb(填“>”“<”“=”)
已知:常温下,A酸的溶液pH=a,B碱的溶液pH=b。
(1)若A为盐酸,B为氢氧化钠,且a+b=14,二者等体积混合,则溶液的pH= 。若酸碱按体积比为1:10混合后溶液显中性,则a+b= 。
(2)若A为醋酸,B为氢氧化钡,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为 mol·L-1,B溶液中水电离出的氢离子浓度为 。mol·L-1
(3)若A为醋酸,B为氢氧化钠,且a+b=14,将体积为VA的醋酸和体积为VB的氢氧化钠溶液混合后,溶液显中性,则其体积关系VA VB,混合后溶液中的离子浓度关系为c(Na+) c(CH3COO-) (填“<”“>”或“=”)。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,其水解反应的离子方程式为 。
(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是_ 。
A. KMnO4 B. H2O2 C. 氯水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。 ( 提示: lg5 =0.7)
)常温下,有下列四种溶液:①pH=4的NH4Cl溶液;②pH=10的NaOH溶液;③pH =4的盐酸;④pH =4的醋酸溶液。请回答下列问题:
(1)溶液中①、②由水电离的c(H+) 分别为a、b ,则a:b="_____________"
(2)将②与④等体积混合,所得溶液pH__7(填“>”、“ <”或“=”、),溶液中离子的物质的量浓度由大到小的顺序是___ _ 。
(3)取等体积的③、④两种溶液,分别加水稀释到pH均等于5,所需水的体积分别为V1 、V2,则V1 ____V2(填“>”、“ <”或“=”)。
(4)取等体积的③、④两种溶液,加入质量不等的锌粒,反应结束后得到等量的H2,下列说法正确的是_____________(填字母符号)
| A.反应所需时间③<④ | B.开始时反应速率③>④ | C.参加反应的锌粒质量③=④ | D.③中锌有剩余 E.④中锌有剩余 F. ④中酸过量 |
常温下,取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8。试回答以下问题:
(1)混合后溶液的pH=8的原因是____________________________(用离子方程式表示)。
(2)混合后的溶液中由水电离出的c(OH-)____0.1 mol/L NaOH溶液中由水电离出的c(OH-) (填“>”、“<”或“=”)。
(3)已知NH4A溶液为中性,又知将HA溶液加到NaHCO3溶液中有气体放出,试推断NH4HCO3溶液的pH________7(填“>”、“<”或“=”)。
(4)有相同温度下相同浓度的四种盐溶液:
| A.NH4HCO3; | B.NH4A; | C.(NH4)2SO4; | D.NH4Cl,按pH由大到小的顺序排列________(填序号)。 |