在25 ℃时,有pH=a(a≤6)的盐酸Va L和pH=b(b≥8)的NaOH溶液Vb L。二者混合恰好完全中和。问:
(1)若a+b=14时,则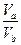 =_________(填数值);
=_________(填数值);
(2)若a+b=13时,则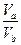 =_________(填数值);
=_________(填数值);
(3)若a+b>14时,则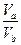 =_________(填表达式),且VaVb(填“>”“<”或“=”)。
=_________(填表达式),且VaVb(填“>”“<”或“=”)。
有等体积、等物质的量浓度的氢硫酸和亚硫酸溶液各两份,分别通入Cl2和O2,溶液的pH变化(y)与通入气体的量x的关系如图3-6所示,则a、b、c、d分别所代表的pH变化与之对应的化学反应分别是: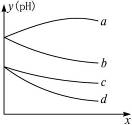
图3-6
| A.在氢硫酸中通入O2_________________; |
| B.在亚硫酸中通入O2_________________; |
| C.在氢硫酸中通入Cl2_________________; |
| D.在亚硫酸中通入Cl2_________________。 |
A、B、C三种一元弱酸的浓度均为0.1 mol·L-1,在室温下,A溶液中C(OH-)=7.6×10-12 mol·L-1,B溶液中水电离产生的H+浓度为10-10 mol·L-1,C溶液的pH=3,则三种溶液的酸性由强到弱的顺序是______________________________。
酸是化学中重要的一类物质,人们对酸的认识是逐步加深的。
⑴ 1887年,阿仑尼乌斯提出了电离理论,在水溶液中能电离出H+的为酸,电离出OH‑离子的为碱。比较水溶液中,下列阴离子的共扼酸的酸性大小_____________________(填序号)
⑵ 1905年,弗兰克提出了溶剂酸碱理论。该理论认为凡是在溶剂中产生该溶剂的特征阳离子的溶质叫酸,产生该溶剂的特征阴离子的溶质叫碱。试判断液NH3中加入Li3N后酸碱性变化情况,并结合方程式解释
⑶ 1923年布朗斯特提出了质子理论。认为凡是能够给出质子的物质都为酸,接受质子的物质为碱。有电子总数相同的三种微粒,它们既是质子酸又是质子碱,且分别为阴离子、中性分子和阳离子,它们是__________________________
⑷ 质子理论提出的同年,路易斯提出了电子理论,凡是接受电子对的为酸,给出电子对的为碱。NH3和NF3的均为路易斯碱, 碱性更强的是_____ __ ,
理由是____________ _______
⑸ 1966年第一个超强酸被偶然发现,通常由质子酸和路易斯酸混合。用SbF5与氟磺酸反应后,可得到一种超强酸H[SbF5(OSO2F)]。写出该超强酸在氟磺酸中的电离方程式。
(6分)从 、
、 、
、 、
、 、
、 五种物质中:
五种物质中:
(1)选取溶于水中会促进水电离,且溶液显碱性的物质,用离子方程式表示溶液其显碱性的原因:
;
(2)选取溶于水会抑制水电离,且溶液显酸性的物质,用化学用语表示其显酸性的原因:
;
(3)选取溶于水会促进水电离,且溶液显酸性的物质,用离子方程式表示溶液其显酸性的原因:
。
在25℃时,有pH=a的盐酸和pH=b的NaOH溶液,取VaL盐酸与NaOH溶液中和,需VbL NaOH溶液,问:
(1)若a+b =14、则Va/Vb= (填数字)。
(2)若a+b =13、则Va/Vb= (填数字)。
(3)若a+b >14、则Va/Vb= (填数字),且Va Vb(填>、<或=)。
(4)若a+b =15、则Va/Vb= (填数字)。
在25℃时若10体积某强酸溶液与1体积的某强碱溶液混合后溶液是碱性,则混合前,该强酸的溶液的pHX与该强碱溶液的pHY之间应满足的关系是______。
A、B两种物质都是由氢、氮、氧、钠四种元素中的任意三种元素组成,它们的水溶液分别呈酸性或碱性。在相同温度下A溶液的pH大于相同浓度的B溶液的pH(溶液浓度不大于10-5mol/L)。请找出A和B可能有的两种组合,并且要求当这两种组合中的B溶液的pH相等时,第一种组合的B溶液中水的电离度小于第二种组合的B溶液中水的电离度。
(1)写出可能有的两种组合中A和B的化学式:第一种组合,A是______;B是______。第二种组合,A是______,B是______。
(2)说明pH相等时,第一种组合的B溶液中水的电离度比第二种组合的B溶液中水的电离度小的原因:______。
(3)在上述的第一种组合中,若A,B的物质的量浓度相同且温度相同,设A溶液中水的电离度是α1,B溶液中水的电离度是α2,那么α1和α2的关系式是______。
液氨与水性质颇为相似,其电离方程式可表示为:2NH3 NH4++NH2-。某温度下其离子积常数为1×10-30(mol·L-1)2。液氨中的pNH4与水中的pH类似,向1L液氨中加入2.3gNa此时上述平衡____________移动(填“向正方向”“向逆方向”或“不”),完全反应后溶液的pNH4=__________。
NH4++NH2-。某温度下其离子积常数为1×10-30(mol·L-1)2。液氨中的pNH4与水中的pH类似,向1L液氨中加入2.3gNa此时上述平衡____________移动(填“向正方向”“向逆方向”或“不”),完全反应后溶液的pNH4=__________。
某温度下纯水中C(H+) = 2×10-7 mol/L,则此时溶液中的C(OH-) = ___________。
若温度不变,滴入稀盐酸使C(H+) = 5×10-6 mol/L,则此时溶液中的C(OH-) = ___________。
(1)与纯水的电离相似,液氨中也存在着微弱的电离:2NH3 NH4++NH2- 据此判断以下叙述中错误的是 ( )
NH4++NH2- 据此判断以下叙述中错误的是 ( )
| A.液氨中含有NH3、NH4+、NH2-等微粒 |
| B.一定温度下液氨中C(NH4+)·C(NH2-)是一个常数 |
| C.液氨的电离达到平衡时C(NH3) = C(NH4+) = C(NH2-) |
| D.只要不加入其他物质,液氨中C(NH4+) = C(NH2-) |
(2)完成下列反应方程式
①在液氨中投入一小块金属钠,放出气体____________________________。
②NaNH2溶于水的反应____________________________。
③类似于“H++OH—=H2O”的反应____________________________。