金属铁是应用广泛,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可利用离子交换和滴定的方法。实验中称取3.25g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用1.0 mol·L-1的盐酸中和滴定,正好中和时消耗盐酸60.0mL。计算该样品中氯的物质的量,并求出FeClx中x的值: (列出计算过程)。
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl) = 1∶2.8,则该样品中FeCl3的物质的量分数为 。
(3)把SO2气体通入FeCl3溶液中,发生反应的离子方程式为 。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为 ;与MnO2—Zn电池类似,K2FeO4—Zn也可以组成碱性电池,其中Zn极的电极反应式为 ,K2FeO4的电极反应式为 。
(12分) ClO2气体是一种常用的消毒剂,我国从2000年起逐步用ClO2代替氯气对饮用水进行消毒。但二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。
(1)欧洲国家主要采用氯酸钠氧化浓盐酸制备ClO2,缺点主要是产率低,产品难以分离,还产生毒副产品。该反应的化学反应方程式为: 。科学家又研究出了一 种新的制备ClO2的方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为 ,此法提高了生产及储存、运输的安全性,原因是 。
(2)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg/L之间。碘量法可以检测水中ClO2的浓度,步骤如下:
I.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2 S2 O3溶液.(已知:2S2O32-+I2=S4O62-+2I-)
III.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如下图所示。
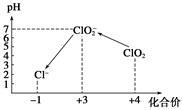
请回答:
①操作I中反应的离子方程式是 。
②在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是 。
③若水样的体积为1.0 L,在操作Ⅱ时消耗了1.0×10一3mol/L的Na2S2O3溶液10 mL,则水样中ClO2的浓度是 mg/L。
(1)常温下,用0.1000mol·L-1NaOH溶液滴定20.00mL0.100 0mol·L-1CH3COOH溶液所得滴定曲线如下图。已知起始①点溶液的pH为3,③点溶液的pH为7,则Ka(CH3COOH)=____________。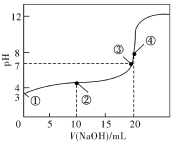
(2)在用Na2SO3溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
| n(SO32-):n(HSO3-) |
91:9 |
1:1 |
9:91 |
| pH |
8.2 |
7.2 |
6.2 |
0.01mol·L-1Na2SO3溶液中通人SO2至溶液呈中性时,溶液中的所有离子的浓度由大到小的顺序是___________________。
(3)向0.1mol·L-1的NaHSO3中通人氨气至溶液呈中性时,溶液中的c(H+)、c(OH-)、c(SO32-)、c(Na+)、c(NH4+)这五种离子浓度大小关系是____________________。
(4)已知Ca3(PO4)2、CaHPO4均难溶于水,而Ca(H2PO4)2易溶,在含0.1molCa(OH)2的澄清石灰水中逐滴加入1mol·L-1的H3PO4,请作出生成沉淀的物质的量随H3PO4滴人体积从0开始至200mL的图像。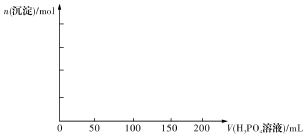
(12分)软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4·H2O ,反应的化学方程式为:MnO2+SO2=MnSO4
(1)质量为17.40g纯净MnO2最多能氧化_____L(标准状况)SO2。
(2)已知:Ksp[Al(OH)3]=1×10-33,Ksp[Fe(OH)3]=3×10-39,pH=7.1时Mn(OH)2开始沉淀。室温下,除去MnSO4溶液中的Fe3+、Al3+(使其浓度小于1×10-6mol·L-1),需调节溶液pH范围为________。
(3)下图可以看出,从MnSO4和MgSO4混合溶液中结晶MnSO4·H2O晶体,需控制结晶温度范围为_______。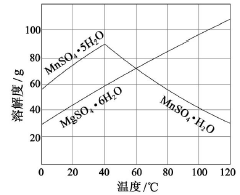
(4)准确称取0.1710gMnSO4·H2O样品置于锥形瓶中,加入适量H2PO4和NH4NO3溶液,加热使Mn2+全部氧化成Mn3+,用c(Fe2+)=0.0500mol·L-1的标准溶液滴定至终点(滴定过程中Mn3+被还原为Mn2+),消耗Fe2+溶液20.00mL。计算MnSO4·H2O样品的纯度(请给出计算过程)
研究在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的主要以4种无机碳形式存在,其中
占95%,写出
溶于水产生
的方程式:。
(2)在海洋循环中,通过下图所示的途径固碳。

①写出钙化作用的离子方程式:。
②同位素示踪法证实光合作用释放出的只来自于
,用
标记物质的光合作用的化学方程式如下,将其补充完整:+=
+
+
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:
①气提、吸收,用
从酸化后的还说中吹出
并用碱液吸收(装置示意图如下),将虚线框中的装置补充完整并标出所用试剂。

②滴定。将吸收液洗后的无机碳转化为,再用
溶液滴定,消耗
溶液,海水中溶解无机碳的浓度=
。
(4)利用下图所示装置从海水中提取,有利于减少环境温室气体含量。

①结合方程式简述提取的原理:。
②用该装置产生的物质处理室排出的海水,合格后排回大海。处理至合格的方法是。
(Ⅰ)六种短周期元素在元素周期表中的相对位置如图所示。其中R元素的最外层电子数是次外层电子数的一半。
| X |
Y |
Z |
M |
| R |
|
W |
|
请回答下列问题:
(1)画出R的原子结构示意图 。
(2)比较Z、W的简单氢化物沸点高低并说明原因 。
(3)W和Y形成的一种化合物甲的相对分子质量为184,其中Y的质量分数约为30%。则化合物甲的化学式为 。
(Ⅱ)聚合硫酸铁简称聚铁[Fe2(OH)n(SO4)(3-0.5n)]m(n>2,m≤10),是一种高效的无机高分子混凝剂、净水剂。实验室利用硫酸亚铁制取聚合硫酸铁的主要流程如下:
(4)FeSO4溶液显弱酸性的原因是 (用离子方程式表示)。
(5)加入浓硫酸调节pH的作用是:① ;② 。
(6)写出用上述流程得到某聚铁[Fe2(OH)4SO4]4的化学方程式
(7)测定聚铁中含铁量的方法为把聚铁溶于过量酸中,先用过量的SnCl2将Fe3+还原成Fe2+,再加入HgCl2溶液除去过量的SnCl2,然后用标准的K2Cr2O7溶液(先加入几滴试亚铁灵指示剂)滴定溶液中的Fe2+。此过程发生的部分反应为:
Sn2++2Hg2++8Cl- = Hg2Cl2↓+SnCl62-
Cr2O72-+14H++6Fe2+ = 2Cr3++6Fe3++7H2O
①用HgCl2除去过量的SnCl2的目的是 。
②称取聚铁质量为10.00 g配成100.0 mL溶液,取出20.00 mL,经上述方法处理后,用0.1000 mol·L-1 K2Cr2O7标准溶液滴定。达到终点时,消耗K2Cr2O7标准溶液12.80 mL。则聚铁中铁元素的质量分数为 %。
硫元素有多种化合价,可形成多种化合物。
(1)常温下用1mol•L-1 100 mL NaOH溶液恰好完全吸收0.1mol SO2气体,此反应的离子方程式为 ;该溶液pH<7的原因是 (结合方程式回答)。以石墨作电极,电解该物质的饱和溶液时,只有一个电极产生气体,写出阳极的电极反应式 。
(2)请按照浓度由大到小的顺序排列0.1mol/LNa2SO3溶液中的离子 。Na2SO3溶液放置于空气中一段时间后,溶液的pH (填“增大”“减小”或 “不变”)。
(3)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。
实验①可说明 (填字母)
| A.该Na2S2O3溶液中水电离的c(OH—)=10—8mol/L |
| B.H2S2O3是一种弱酸 |
| C.Na2S2O3是一种弱电解质 |
D.Na2S2O3水解方程式为S2O32—+2H2O H2S2O3+2OH— H2S2O3+2OH— |
写出实验②发生反应的离子方程式 。
(4)实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。
5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O)。试回答:
①此滴定实验是否需要指示剂 (填“是”或“否”),KMnO4溶液置于 (填“酸式”或“碱式”)滴定管中。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果 (填“偏高”“偏低”或“不变”)。
③产品中Na2S2O3·5H2O的质量分数为 。(Na2S2O3·5H2O式量:248)(保留小数点后两位数)
(12分)聚合氯化铁铝(简称PAFC),其化学通式为[FexAly(OH)aClb·zH2O]m。某同学为测定其组成,进行如下实验:
①准确称取4.505 0 g样品,溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到2.330 0 g固体。
②另准确称取等质量样品溶于水,在溶液中加入适量Zn粉和稀硫酸,将Fe3+完全还原为Fe2+。用0.100 0 mol·L-1标准KMnO4溶液滴定Fe2+,消耗标准溶液的体积为20.00 mL。
③另准确称取等质量样品,用硝酸溶解后,加入足量AgNO3溶液,得到4.305 0 g白色沉淀。
(1)若滴定管在使用前未用KMnO4标准溶液润洗,测得的Al3+含量将________(填“偏高”“偏低”或“不变”)。
(2)实验室检验Fe3+常用的方法是__________________。
(3)通过计算确定PAFC的化学式(写出计算过程;m为聚合度,不必求出)。
(14分)工业生产中产生的SO2、NO直接排放将对大气造成严重污染。利用电化学原理吸收SO2和NO,同时获得 Na2S2O4和 NH4NO3产品的工艺流程图如下(Ce为铈元素)。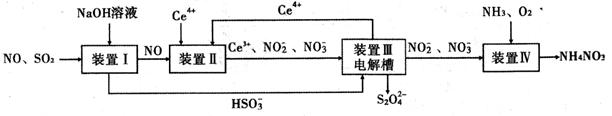
请回答下列问题。
(1)装置Ⅱ中NO在酸性条件下生成NO2—的离子方程式 。
(2)含硫各微粒(H2SO3、HSO3—和SO32—)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数ω与溶液pH的关系如下图所示。
①下列说法正确的是 (填标号)。
| A.pH=7时,溶液中c( Na+)<c (HSO-3) + c(SO2-3) |
| B.由图中数据,可以估算出H2SO3的第二级电离平衡常数Ka2≈10-7 |
| C.为获得尽可能纯的 NaHSO3,应将溶液的pH控制在 4~5为宜 |
| D.pH=2和 pH=9时的溶液中所含粒子种类不同 |
②若1L1mol/L的NaOH溶液完全吸收13.44L(标况下)SO2,则反应的离子方程式为 。
③取装置Ⅰ中的吸收液vmL,用cmol/L的酸性高锰酸钾溶液滴定。酸性高锰酸钾溶液应装在 (填“酸式”或“碱式”)滴定管中,判断滴定终点的方法是 。
(3)装置Ⅲ的作用之一是再生Ce4+,其原理如下图所示。图中A为电源的 (填“正”或“负”)极。右侧反应室中发生的主要电极反应式为 。
(4)已知进入装置Ⅳ的溶液中NO2—的浓度为 0.4 mol/L ,要使 1m3该溶液中的NO2—完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的 O2的体积为 L。
【改编】(16分)铁是地壳中含量第二的金属元素,其单质、合金及化合物在生产生活中的应用广泛。
(一)(1)氯化铁溶液常用作印刷电路铜板腐蚀剂,反应的离子方程式为 ;腐蚀废液回收得到金属铜还需要的试剂为 。
(2)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是 。
(3)下表中,对陈述I、II及其有无因果关系的判断,都正确的是_____(填字母)
| 选项 |
陈述I |
陈述II |
判断 |
| A |
铁是地壳中含量最高的金属元素 |
铁是人类最早使用的金属材料 |
I对;II对;有 |
| B |
常温下铁与稀硫酸反应生成氢气 |
高温下氢气能还原氧化铁生成铁 |
I对;II对;无 |
| C |
铁属于过渡金属元素 |
铁和铁的某些化合物可以用作催化剂 |
I错;II对;无 |
| D |
铁在空气中表面生成致密氧化膜 |
可用铁罐储存运输浓硫酸、浓硝酸 |
I对;II对;有 |
(二)氮化铁磁粉是一种磁记录材料,利用氨气在4000C以上分解得到的氮原子渗透到高纯铁粉中可制备氮化铁。制备高纯铁粉涉及的主要生产流程如下:


已知:①某赤铁矿石含60.0% Fe2O3、3.6% FeO,还含有A12O3、MnO2、CuO等。
②部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下:

(4)步骤②中加双氧水的目的是 ,pH控制在3.4的作用是 。已知25°C时, ,该温度下反应:Cu2++2H2O
,该温度下反应:Cu2++2H2O Cu(OH)2+2H+的平衡常数K= 。
Cu(OH)2+2H+的平衡常数K= 。
(5)如何判断步骤③中沉淀是否洗涤干净?___________________________
(6)制备氮化铁磁粉的反应: (未配平),若整个过程中消耗氨气34.0 g,消耗赤铁矿石2 kg,设整个过程中无损耗,则氮化铁磁粉的化学式为 。
(未配平),若整个过程中消耗氨气34.0 g,消耗赤铁矿石2 kg,设整个过程中无损耗,则氮化铁磁粉的化学式为 。
脱去冶金工业排放烟气中SO2的方法有多种。
(1)热解气还原法。已知CO还原SO2生成S(g)和CO2过程中,每转移1mol电子需吸收2.0 kJ的热量,则该反应的热化学方程式为 。
(2)离子膜电解法。利用硫酸钠溶液吸收SO2,再用惰性电极电解。将阴极区溶液导出,经过滤分离硫磺后,可循环吸收利用,装置如图1所示,则阴极的电极反应式为 ,阳极产生气体的化学式为 。
(3)氧化锌吸收法。配制ZnO悬浊液(含少量MgO、CaO),在吸收塔中封闭循环脱硫,发生的主要反应为ZnO+SO2 = ZnSO3(s),测得pH、吸收效率η随时间t的变化如图2所示。
①该反应常温能自发进行的原因是 。
②纯ZnO的悬浮液pH约为6.8,结合图2和图3,下列说法正确的是 。
A.向ZnSO3与水混合体系中加稀硫酸,硫元素会以SO2形式逸出
B.pH-t曲线ab段发生的主要反应为ZnO+SO2=ZnSO3
C.pH-t曲线cd段发生的主要反应为ZnSO3+SO2+H2O =" Zn" (HSO3)2
D.pH=7时,溶液中c(SO32-) = c(HSO3-)
③为提高SO2的吸收效率η,可采取的措施为 。
A.增大悬浊液中ZnO的量
B.适当提高单位时间内烟气的循环次数
C.调节溶液的pH至6.0以下
钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。
(1)CoxNi(1-x)Fe2O4(其中Co、Ni均为+2)可用作H2O2分解的催化剂,具有较高的活性。
①该催化剂中铁元素的化合价为 。
②图1表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知: 法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果更好的是 。
(2)草酸钴是制备钴的氧化物的重要原料。下图2为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。
①通过计算确定C点剩余固体的化学成分为 (填化学式)。试写出B点对应的物质与O2在225℃~300℃发生反应的化学方程式: 。

②取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL 5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比。
在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,溶液中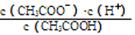 (填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 。
(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式 。
(2)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因 。加入石膏(CaSO4·2H2O)可以使土壤碱性降低,有关反应的化学方程式为 。
(3)常温下向20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下: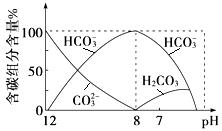
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32- (填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒有 、 ,溶液中含量最多的三种微粒的物质的量浓度的大小关系为 ;
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡。根据要求回答问题
(1)生活中明矾常作净水剂,其净水的原理是 (用离子方程式表示)。
(2)常温下,取0.2 mol·L-1 HCl溶液与0.2 mol·L-1 MOH溶液等体积混合,测得混合溶液后的pH=5。写出MOH的电离方程式: 。
(3)0.1mol/L的NaHA溶液中,测得溶液中的显碱性。则
①该溶液中c(H2A) c(A2-)(填“>”、“<”或“=”)。
②作出上述判断的依据是 (用文字解释)。
(4)含Cr2O 的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O
的废水毒性较大,某工厂废水中含5.0×10-3 mol·L-1的Cr2O 。为了使废水的排放达标,进行如下处理:
。为了使废水的排放达标,进行如下处理:
①绿矾为FeSO4·7H2O。反应(I)中Cr2O72-与FeSO4的物质的量之比为 。
②常温下若处理后的废水中c(Cr3+)=6.0×10-7 mol·L-1,则处理后的废水的pH=______。(Ksp[Cr(OH) 3]=6.0×10-31)