浙江省金华十校高三下学期高考模拟(4月)理综化学试卷
化学与科学、社会、技术和环境密切相关。下列有关说法中错误的是
| A.目前科学家已制得单原子层锗,其电子迁移率是硅的10倍,有望用于制造高能计算机芯片 |
| B.2014年在西非国家爆发了埃博拉疫情,埃博拉病毒对化学药品敏感,乙醇、次氯酸钠溶液均可以将病毒氧化而达到消毒的目的 |
| C.2014年德美科学家因开发超分辨荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代。利用此类光学显微镜可以观察活细胞内蛋白质等大分子 |
| D.绿色化学期望利用化学原理从源头消除污染,在生产过程中充分利用原料,实现零排放 |
下列说法不正确的是
| A.用干燥洁净的玻璃棒蘸取NaClO溶液,滴到放在表面皿上的pH试纸上测pH |
| B.实验时受溴腐蚀致伤,先用苯或甘油洗伤口,再用水洗 |
| C.可用重结晶法提纯含少量NaCl的KNO3晶体 |
| D.容量瓶、滴定管上都标有使用温度,容量瓶无“0”刻度,滴定管有“0”刻度;使用前水洗后滴定管还需润洗,而容量瓶不需要润洗 |
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且原子的最外层电子数之和为15;X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
| A.原子半径:W>Z>Y>X>M |
| B.XZ2、X2M2、W2Z2均为直线型的共价化合物 |
| C.由X元素形成的单质不一定是原子晶体 |
| D.由X、Y、Z、M四种元素形成的化合物一定既有离子键、又有共价键 |
下列说法正确的是
A. 的名称为2-甲基-4-乙基戊烷 的名称为2-甲基-4-乙基戊烷 |
B. 互为同分异构体 互为同分异构体 |
| C.糖类、油脂、蛋白质的水解产物都是非电解质 |
| D.用浸泡过高锰酸钾溶液的硅藻土保鲜水果 |
乙醛酸(HOOC-CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图所示。该装置中阴、阳两极为惰性电极,两极室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。下列说法不正确的是
| A.N电极上的电极反应式:HOOC-COOH+2e-+2H+=HOOC-CHO+H2O |
| B.若有2 mol H+ 通过质子交换膜并完全参与反应,则该装置中生成的乙醛酸为1 mol |
| C.M电极上的电极反应式为:2Cl--2e-=Cl2↑ |
| D.乙二醛与M电极的产物反应生成乙醛酸的化学方程式: Cl2+OHC-CHO+ H2O = HOOC-CHO+2HCl |
25℃时,有c(CH3COOH)+c(CH3COO-)=0.1mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如图所示。下列有关溶液中离子浓度关系的叙述不正确的是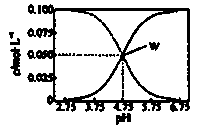
| A.25℃时,醋酸的电离常数Ka=1×10-4.75 |
| B.W点所表示的溶液中:c(Na+)+c(H+)=c(CH3COOH)+c(OH-) |
| C.pH=5.5的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
| D.pH=3.5的溶液中:c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1mol·L-1 |
一包由常见盐混合组成的白色粉末,其中只可能含有Na+、K+、Al3+、CO32-、HCO3-、SO42-、SO32-、NO3-中的若干种离子。某同学对该粉末进行如下实验:以下说法正确的是
| A.白色沉淀甲是Al(OH)3,气体甲是CO2,原混合物中一定含有Al3+和HCO3- |
| B.白色沉淀乙是BaSO4,原混合物中一定含有SO42- |
| C.气体乙一定是NO和NO2的混合气体 |
| D.原混合物中一定含有Na+、Al3+、NO3-、SO32- |
煤的气化产物CO和H2是重要的化工原料。某些简单的有机物和CO反应合成具有优良性能材料的基本过程如图所示。
已知:①E由CO和H2按物质的量之比为1:1完全反应而成;
②A由CO和H2按物质的量之比为1:2完全反应而成。
回答下列问题:
(1)E的结构简式 ;B中的官能团名称 。
(2)下列说法不正确的是 。
A.HC CH可以与氯化氢反应,得到氯乙烯 CH可以与氯化氢反应,得到氯乙烯 |
| B.CH2=CH2可由石油裂化得到,一定条件下可制得聚乙烯塑料 |
| C.由B生成D的反应类型是加聚反应 |
| D.可用溴水鉴别CH3CH2COOH与CH2=CHCOOH |
(3)写出反应①的化学方程式 ,属于 反应。
(Ⅰ)六种短周期元素在元素周期表中的相对位置如图所示。其中R元素的最外层电子数是次外层电子数的一半。
| X |
Y |
Z |
M |
| R |
|
W |
|
请回答下列问题:
(1)画出R的原子结构示意图 。
(2)比较Z、W的简单氢化物沸点高低并说明原因 。
(3)W和Y形成的一种化合物甲的相对分子质量为184,其中Y的质量分数约为30%。则化合物甲的化学式为 。
(Ⅱ)聚合硫酸铁简称聚铁[Fe2(OH)n(SO4)(3-0.5n)]m(n>2,m≤10),是一种高效的无机高分子混凝剂、净水剂。实验室利用硫酸亚铁制取聚合硫酸铁的主要流程如下:
(4)FeSO4溶液显弱酸性的原因是 (用离子方程式表示)。
(5)加入浓硫酸调节pH的作用是:① ;② 。
(6)写出用上述流程得到某聚铁[Fe2(OH)4SO4]4的化学方程式
(7)测定聚铁中含铁量的方法为把聚铁溶于过量酸中,先用过量的SnCl2将Fe3+还原成Fe2+,再加入HgCl2溶液除去过量的SnCl2,然后用标准的K2Cr2O7溶液(先加入几滴试亚铁灵指示剂)滴定溶液中的Fe2+。此过程发生的部分反应为:
Sn2++2Hg2++8Cl- = Hg2Cl2↓+SnCl62-
Cr2O72-+14H++6Fe2+ = 2Cr3++6Fe3++7H2O
①用HgCl2除去过量的SnCl2的目的是 。
②称取聚铁质量为10.00 g配成100.0 mL溶液,取出20.00 mL,经上述方法处理后,用0.1000 mol·L-1 K2Cr2O7标准溶液滴定。达到终点时,消耗K2Cr2O7标准溶液12.80 mL。则聚铁中铁元素的质量分数为 %。
开发新能源、新材料是实现社会可持续发展的需要。请回答下列问题:
(1)下图是2LiBH4/MgH2体系放氢焓变示意图。
则:Mg(s)+2B(s)=MgB2(s) ΔH= 。
(2)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:25℃水浴时,每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系如图所示。下列说法正确的是 (填字母)。
A.25℃时,纯铝与水不反应
B.25℃时,纯LiBH4与水反应产生氢气
C.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
(3)工业上可采用CO和H2合成再生能源甲醇,其反应的化学方程式为
CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
①在一容积可变的密闭容器中,充有10 mol CO和20 mol H2,用于合成甲醇。
CO的平衡转化率(α)与温度(T)、压强(P)的关系如图所示:
上述合成甲醇的反应为 反应(填“放热”或“吸热”)。平衡常数KA、KB、KC的大小关系为 。若达到平衡状态A时容器的体积为10 L,则平衡状态B时容器的体积为 L。
②图中虚线为该反应在使用催化剂条件下,起始H2、CO投料比和CO平衡转化率的关系图。当其他条件完全相同时,用实线画出不使用催化剂情况下,起始H2、CO投料比和CO平衡转化率的关系示意图。
(4)己知参与电极反应的电极材料单位质量放出电能的大小称为该电池的比能量。关于二甲醚(CH3OCH3)碱性燃料电池与乙醇碱性燃料电池,下列说法正确的是 (填字母)。
A.两种燃料互为同分异构体,分子式和摩尔质量相同,比能量相同
B.两种燃料所含共价键数目相同,断键时所需能量相同,比能量相同
C.两种燃料所含共价键类型不同,断键时所需能量不同,比能量不同
(5)LiFePO4与Li1-xFePO4作为磷酸亚铁锂电池电极材料,充放电过程中,发生LiFePO4与Li1-xFePO4之间的转化,电池放电时负极发生的反应为LixC6-xe-═xLi++6C,写出电池放电时反应的化学方程式 。
二草酸合铜(Ⅱ)酸钾晶体{K2[Cu(C2O4)2]·2H2O}制备流程如下:
(已知:H2C2O4 CO↑+CO2↑+H2O)
CO↑+CO2↑+H2O)
(1)制备CuO:CuSO4溶液中滴入NaOH溶液,加热煮沸、冷却、双层滤纸过滤、洗涤。
①用双层滤纸过滤的原因是 。
②用蒸馏水洗涤氧化铜时,如何证明氧化铜已洗涤干净 。
(2)为了提高CuO的利用率,如何让CuO充分转移到热的KHC2O4溶液中 ;50℃水浴加热至反应充分,发生反应的化学方程式为 ;再经趁热过滤、沸水洗涤、将滤液蒸发浓缩得到二草酸合铜(Ⅱ)酸钾晶体。
(3)本实验用K2CO3粉末与草酸溶液反应制备KHC2O4,而不用KOH粉末代替K2CO3粉末,其主要原因是 。
(4)二草酸合铜(Ⅱ)酸钾晶体的制备也可以用CuSO4晶体和K2C2O4溶液反应得到。从硫酸铜溶液中获得硫酸铜晶体的实验步骤为:加入适量乙醇、蒸发浓缩、冷却结晶、过滤、洗涤、干燥。①加入适量乙醇的优点有:
a.缩短加热的时间,降低能耗;
b. 。
②在蒸发浓缩的初始阶段还采用了如图所示的装置,其目的是 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号