已知2Fe3++2I-=2Fe2++I2、Br2+2Fe2+=2Fe3++2Br-。现向含有FeBr2、FeI2的某溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色,则下列叙述中正确的是
①按Br2、Fe3+、I2的顺序氧化性逐渐减弱
②原溶液中Br-一定被氧化
③通入氯气后原溶液中的Fe2+一定被氧化
④不能确定通入氯气后的溶液中是否还存在Fe2+
⑤若取少量所得溶液,加入CCl4后静置,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中Fe2+、Br-均被完全氧化
| A.①②③④ | B.①③④⑤ | C.②④⑤ | D.①②③④⑤ |
已知还原性Cl-< Br-< Fe2+<I-,氧化性Cl2>Br2>Fe3+> I2,则下列说法正确的是
| A.在含有Br-、Fe2+、I一的溶液中欲只氧化I一而不氧化Br-、Fe2+,可用FeBr3作试剂 |
| B.向FeI2溶液中通入少量Cl2,反应的离子方程式为:2Fe2++ Cl2=2Fe3++ 2C1- |
| C.向FeBr2溶液中通入足量Cl2,反应的离子方程式为:2Fe2+ +2Br-+2Cl2=2Fe3++ Br2+4CI- |
| D.向FeCl2溶液中滴加足量碘水,能发生反应:2Fe2++ I2=2Fe3++ 2I- |
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:
在足量的稀氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色。
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生化学反应所致,则溶液呈黄色是含 (填化学式,下同)所致。
②乙同学认为氧化性:Br2>Fe3+,故上述实验现象是发生化学反应所致,则溶液呈黄色是含 所致。
(3)设计实验并验证:丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的。
供选用的试剂:a.酚酞试液 b.四氯化碳 c.无水酒精 d.硫氰化钾溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象。(试剂填序号)
| |
选用试剂 |
实验现象 |
| 方案1 |
|
|
| 方案2 |
|
|
(4)应用与拓展:
①在足量的稀氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为 。
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有1/3的Br–被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为 。
Ⅰ.为了除去KCl溶液中少量的Mg2+、SO42-,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作:
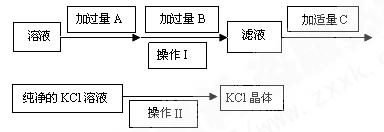
(1)上述试剂中,B是 ,C是 。
(2)操作Ⅱ的名称是 。
(3)加过量A时发生有关反应的离子方程式为 、 。
Ⅱ.一份溶液中可能含有K+、Al3+、H+、NH4+、Cl-、Br-、I-、ClO-、AlO2- 等离子中的若干种。为了确定溶液的组成,进行了如下操作:

(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积关系如图所示;则该溶液中一定存在的离子是 ,一定不存在的离子是 。
(2)经检测后,该溶液中含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的氯气,则溶液中Cl-、Br-、I-与通入氯气的体积(标况下)关系如表所示,回答下列问题:
| Cl2的体积(标况下) |
2.8L |
5.6L |
11.2L |
| n(Cl-) |
1.25mol |
1.5 mol |
2 mol |
| n(Br-) |
1.5 mol学] |
1.4mol |
0.9 mol |
| n(I-) |
a mol |
0 |
0 |
①则a为
②原溶液中Cl-、Br-、I-的物质的量浓度之比为
已知酸性高锰酸钾溶液可以将FeSO4氧化,反应的化学方程式为 2KMnO4+10FeSO4+8H2SO4===K2SO4+X+5Fe2(SO4)3+8H2O,现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示,则下列有关说法不正确的是
| A.方程式中的X为2MnSO4 |
| B.氧化性:KMnO4>Fe3+>I2 |
| C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.30 mol |
| D.AB段是高锰酸钾和碘化钾溶液反应,BC段的反应为2Fe3++2I-===2Fe2++I2 |
已知2Fe3++2I-=2Fe2++I2、Br2+2Fe2+=2Fe3++2Br-。现向含有FeBr2、FeI2的某溶液中通入一定量的氯气,再向反应后的溶液中滴加少量的KSCN溶液,结果溶液变为红色,则下列叙述中正确的是
①按Br2、Fe3+、I2的顺序氧化性逐渐减弱
②原溶液中Br-一定被氧化
③通入氯气后原溶液中的Fe2+一定被氧化
④不能确定通入氯气后的溶液中是否还存在Fe2+
⑤若取少量所得溶液,加入CCl4后静置,向上层溶液中加入足量的AgNO3溶液,只产生白色沉淀,说明原溶液中Fe2+、Br-均被完全氧化
| A.①②③④ | B.①③④⑤ | C.②④⑤ | D.①②③④⑤ |
1L某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 |
H+ NH4+ Al3+ K+ |
| 可能大量含有的阴离子 |
Cl- Br- I- ClO- AlO2- |
(1)往该溶液中逐滴加入NaOH溶液并适当加热,产生沉淀和气体的物质的量(n)与加入NaOH溶液的体积(v)的关系如下图所示。
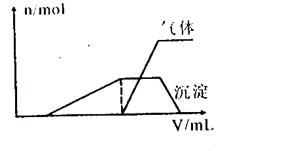
则该溶液中确定含有的离子有 ;肯定不含有的离子有 ,滴加氢氧化钠过程中发生反应的先后顺序为(用离子方程式表示) 。
(2)若经检测,该溶液中含有大量的Cl—、Br—、I—,若向1L该混合溶液中通入一定量的Cl2,溶液中Cl—、Br—、I—的物质的量与通入Cl2的体积(标准状况下)的关系如下图所示,回答下列问题:
| Cl2的体积(标准状况) |
2.8L |
5.6L |
11.2L |
| n (Cl-) |
1.25mol |
1.5mol |
2mol |
| n (Br-) |
1.5mol |
1.4mol |
0.9mol |
| n(I-) |
a mol |
0 |
0 |
①当通入的Cl2的体积为2.8L时,溶液中发生反应的离子方程式为: ,a= 。
②原溶液中Cl—、Br—、I—的物质的量浓度之比为 。
已知酸性条件下有以下反应关系: ①KBrO3能将KI氧化成I2或KIO3,其本身被还原为Br2。②Br2能将I-氧化为I2。③KIO3能将I-氧化为I2,也能将Br-氧化为Br2,其本身被还原为I2。现向含有1 mol KI的硫酸溶液中加入含amol KBrO3的溶液,a的取值不同,所得产物也不同。下列判断正确的是:
| 编号 |
a的取值范围 |
产物的化学式 |
| ① |
a≤1/6 |
I2、Br- |
| ② |
1/6<a<1/5 |
I2、Br-、Br2 |
| ③ |
1/5<a<6/5 |
I2、IO3-、Br2 |
| ④ |
a≥6/5 |
IO3-、Br2 |
A.①③④ B.②③④ C.①②③④ D.①④
卤化物和卤酸盐在工业生产中有着重要的作用。某小组为探究其中一些盐的性质,查阅资料并进行实验。查阅资料如下:
① BrO3- + 6I- + 6H+ = 3I2+ Br-+ 3H2O
② 2BrO3- + I2= 2IO3- + Br2
③ IO3- + 5I- + 6H+ = 3I2+ 3H2O
④ 2IO3- + 10Br-+ 12H+ = I2+ 5Br2+ 6H2O
实验如下:
| 步骤 |
现象 |
| ⅰ. 向盛有30 mL 0.2 mol·L-1 KI溶液的锥形瓶中依次滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 |
随着KBrO3溶液的滴入,溶液由无色变为蓝色并逐渐加深,最终保持不变 |
| ⅱ. 继续向上述溶液中滴入KBrO3溶液 |
溶液的蓝色逐渐褪去 |
请回答:
(1)步骤ⅰ开始时发生的反应如资料①所示,溶液中I-完全被氧化时转移 mol e-,该反应中硫酸表现出的化学性质是 。
(2)上述资料中的反应 (填序号)可表示步骤ⅱ中的反应,通过该反应 (填“能”或“不能”)说明碘的非金属性强于溴,原因是 。
(3)根据资料中的反应①~④并结合所学知识,判断IO3-、BrO3-、I2、Br2的氧化性由强到弱的顺序是 ;KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是 。
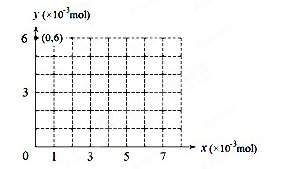
(4)若用y表示锥形瓶中含碘物质的物质的量,用x表示所滴入KBrO3的物质的量,在图中画出上述整个实验过程中y随x的变化曲线(要求:在图中标出终点坐标)。
为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。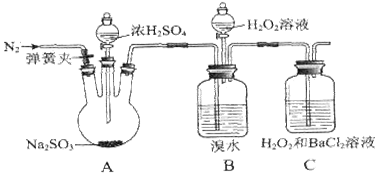
| 实验操作 |
实验现象 |
| ⅰ.打开A中分液漏斗活塞,滴加浓硫酸 |
A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
| ⅱ.取C中沉淀加入盐酸 |
C中白色沉淀不溶解 |
| ⅲ.打开B中分流漏斗活塞,逐滴滴加H2O2 |
开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(1)A中发生反应的化学方程式是_______________________
(2)甲同学通过C中产生白色沉淀,得出结论,氧化性:H2O2>SO2。
①乙同学认为不能得出此结论,认为在滴加浓硫酸之前应增加一步操作,该操作是_____________。
②丙同学认为还应该在B和C之间增加洗气瓶D,D中盛放的试剂是____________
③将乙和丙同学改进后的方案进行实验,C中产生白色沉淀,得出结论:氧化性H2O2>SO2。
(3)ⅲ中滴入少量H2O2没有明显变化。提出假设:
观点1:H2O2的量少不能氧化Br―
观点2:B中有未反应的H2SO3
为验证观点2,应进行的实验操作及现象是___________________________________
(4)通过上述全部实验,得出结论:H2O2、SO2、Br2氧化性由强到弱的顺序是________。
(9分)某校学生化学实验小组,为验证非金属元素氯的氧化性强于硫和氮,设计了一套实验装置:(部分夹持装置已略去)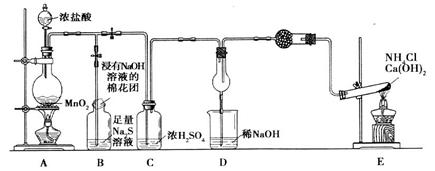
(1)写出A中反应的离子方程式_________。
(2)实验中证明氧化性Cl2>S的离子方程式为___________。
(3)D中干燥管中产生大量白烟,该反应的化学方程式为________。
(4)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,该装置中盛装的试剂名称为____
(5)E装置中反应的化学方程式为_______________________。
(8分)实验探究是体验知识的产生和形成过程的基本途径。下面是某同学完成的探究实验报告的一部分:
实验名称:卤素单质的氧化性强弱比较
| 实验步骤 |
实验结论 |
| ①氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
氧化性从强到弱的顺序:氯、溴、碘 |
| ②NaBr溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
|
| ③KI溶液+氯水+1 mL CCl4,振荡,静置,观察四氯化碳层颜色 |
实验药品:KBr溶液、KI溶液、氯水、溴水、碘水、四氯化碳、淀粉碘化钾试纸
实验设计如下,请回答:
(1)完成该实验需用到的实验仪器是________、________。
(2)②中反应的化学方程式为________________。
③中反应的离子方程式为__________________。
(3)CCl4在实验中所起的作用是________。
(4)该同学的实验设计不足之处是___________________,改进的办法是____________。
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度等有关,下列各组物质:
①Cu和HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液
由于浓度不同而能发生不同氧化还原反应的是
| A.①③ | B.③④ | C.①② | D.①③④ |
将甲、乙两种金属的性质相比较,已知:
①甲与H2O反应比乙与H2O反应剧烈;
②甲单质能从乙的盐溶液中置换出单质乙;
③甲的最高价氧化物对应水化物的碱性比乙的最高价氧化物对应水化物的碱性强;
④与非金属单质反应时,甲原子失电子数目比乙原子失电子数目多;
⑤甲单质的熔、沸点比乙的低。能说明甲的金属性比乙强的是
| A.①④ | B.①②③ | C.③⑤ | D.①②③④⑤ |
化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:2FeCl3+2HI=2FeCl2+I2+2HCl;2Co(OH)3+6HCl =2CoCl2+Cl2↑+6H2O;
2Fe(OH)2+ I2+2KOH = 2Fe(OH)3+2KI; 3I2+6KOH=5KI+KIO3+3H2O
复分解反应:2HSCN +K2CO3 =" 2KSCN" + CO2 ↑ + H2O; KCN + CO2 + H2O =" HCN" + KHCO3
热分解反应:4NaClO 3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4  NaCl + 2O2↑
NaCl + 2O2↑
下列说法不正确是
| A.酸性(水溶液):HSCN > H2CO3 > HCN |
| B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3 |
| C.热稳定性:NaCl > NaClO4 > NaClO |
| D.氧化性(酸性溶液):FeCl3 > Co(OH)3 > I2 |