微生物燃料电池(Microbial Fuel Cell,MFC)是一种利用微生物将有机物中的化学能直接转化成电能的装置。最早用于有机废水处理,下图是利用微生物燃料电池处理含甲醛废水的装置,其中3是质子交换膜,下列有关说法不正确的是
A.负极发生的反应为:HCHO-4e-+H2O=CO2+4H+
B.负极所在的左室中需保持厌氧环境
C.O2参与正极反应,发生还原反应
D.NH4+通过循环操作最终被转化成N2
美国一个海军航空站安装了一台250 kW的MCFC型燃料电池。该电池可同时供应电和蒸汽,其燃料为H2,电解质为熔融的K2CO3,工作温度为600~800 ℃。已知该电池的总反应为2H2+O2 2H2O,负极反应为H2+
2H2O,负极反应为H2+ -2e-
-2e- H2O+CO2。下列推断正确的是
H2O+CO2。下列推断正确的是
A.正极反应为4OH--4e- O2↑+2H2O O2↑+2H2O |
B.放电时, 向负极移动 向负极移动 |
| C.电池供应1 mol水蒸气,转移的电子的物质的量为4 mol |
D.放电时 向正极移动 向正极移动 |
新型NaBH4—H2O2燃料电池(DBFC)的结构如图所示(已知.NaBH4中氢为-1价),有关该电池的说法不正确的是
A.放电过程中.Na+从A极区向B极区迁移
B.电极B材料中含MnO2层,MnO2起导电作用
C.在电池反应中,每消耗1 L 6 mol/LH2O2溶液,理论上流过电路中的电子为12 NA
D.电池负极区的电极反应为BH4—+8OH——8e—=BO2—+6H2O
随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”。特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1﹣xCoO C6+LiCoO2。下列说法不正确的是
C6+LiCoO2。下列说法不正确的是
| A.据题意分析可知该隔膜只允许Li+通过,放电时 Li+从左边流向右边 |
| B.充电时,A为阴极,发生还原反应 |
| C.放电时,B为正极,电极反应式为:Li1﹣xCoO2+xLi++xe﹣=LiCoO2 |
| D.废旧钴酸锂(LiCoO2)电池进行“放电处理”让Li+进入石墨中而有利于回收 |
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为:3Zn+2K2FeO4+8H2O 3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
3Zn(OH)2+2Fe(OH)3+4KOH。下列叙述不正确的是
| A.放电时负极反应为:3Zn-6e-+6OH-====3Zn(OH)2 |
B.充电时阳极反应为:Fe(OH)3-3e-+5OH- FeO42- +4H2O FeO42- +4H2O |
| C.放电时每转移3 mol电子,正极有1 mol K2FeO4被还原 |
| D.充电时阴极溶液的碱性减弱 |
NO2、O2和熔融KNO3可制作燃料电池,其原理如图,该电池在使用过程中石墨I电极上生成氧化物Y,Y可循环使用。下列说法正确的是
| A.O2在石墨Ⅱ附近发生氧化反应 |
| B.该电池放电时NO3-向石墨Ⅱ电极迁移 |
C.石墨Ⅰ附近发生的反应:3NO2 +2e- NO+ 2NO3- NO+ 2NO3- |
| D.相同条件下,放电过程中消耗的NO2和O2的体积比为4∶1 |
(12分)二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H =-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g) △H =-akJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如下图所示。

①能说明该反应已达平衡状态的是________
A.CO2的体积分数在混合气体中保持不变
B.混合气体的密度不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.反应中H2O与CH3OH的物质的量浓度之比为1:1, 且保持不变
②下列措施中能使 增大的是________ (选填编号)。
增大的是________ (选填编号)。
A.升高温度
B.恒温恒容下充入He(g)
C.将H2O(g)从体系中分离
D.恒温恒容再充入2 mol CO2和3 mol H2
③计算该温度下此反应的平衡常数K=___________ , 若改变条件 (填选项),可使K=1。
A增大压强 B增大反应物浓度 C.降低温度
D.升高温度 E.加入催化剂
|
(2)某甲醇燃料电池原理如图1所示:M区发生反应的电极反应式为_______________________________。

我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其它材料电池,电池总反应为:V2O5+xLi LixV2O5。下列说法中正确的是
LixV2O5。下列说法中正确的是
| A.锂在放电时做正极材料,充电时为阳极材料 |
| B.电池在放电时,Li+向负极移动 |
| C.该电池充电时阳极的反应为:LixV2O5-xe-=V2O5 + xLi+ |
| D.V2O5只是锂发生反应的载体,不参与电池反应 |
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如下图所示:
下列说法不正确的是
| A.放电时,电极A为负极 |
| B.根据上表数据,该电池工作的适宜温度应控制在350~2050℃ |
| C.充电时,Na+的移动方向为从电极B到电极A |
| D.充电时,总反应为Na2Sx==2Na+xS(3<x<5),则阳极的电极反应式为Sx-2e-==xS |
据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如下图所示。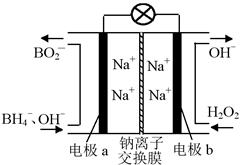
下列说法错误的是( )
| A.电池放电时Na+从a极区移向b极区 |
| B.电极b采用MnO2,MnO2既作电极材料又有催化作用 |
C.该电池的负极反应为:BH +8OH--8e-=BO +8OH--8e-=BO +6H2O +6H2O |
| D.每消耗3 mol H2O2,转移的电子为3 mol |
已知外电路中,电子由铜流向a极。有关下图所示装置的分析中,合理的一项是
| A.一段时间后Zn电极逐渐溶解 |
| B.该装置中Cu极为正极,发生还原反应 |
| C.b极反应的电极反应式为:H2-2e-=2H+ |
D.电流方向: |
为充分利用海洋资源,研究人员发明海水电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列说法错误的是
| A.负极反应式: Ag+Cl-e-=AgCl |
| B.每生成1 mol Na2Mn5O10转移2 mol电子 |
| C.Na2Mn5O10是还原产物 |
| D.Cl-不断向电池的正极移动 |
随着各地“限牌”政策的推出,电动汽车成为汽车届的“新宠”。特斯拉全电动汽车使用的是钴酸锂(LiCoO2)电池,其工作原理如右图,A 极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许特定的离子通过,电池反应式LixC6+Li1-xCoO2 C6+LiCoO2。下列说法不正确的是
C6+LiCoO2。下列说法不正确的是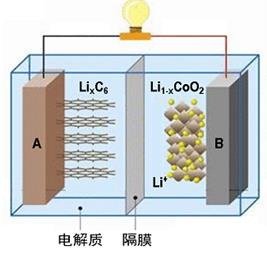
| A.据题意分析可知该隔膜只允许Li+通过,放电时Li+从左边流向右边 |
| B.放电时,正极锂的化合价未发生改变 |
| C.充电时B作阳极,该电极放电时的电极反应式为:Li1-x CoO2+ xLi++ xe-= LiCoO2 |
| D.废旧钴酸锂(LiCoO2)电池进行“放电处理”让Li+进入石墨中而有利于回收 |
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是:Ni(OH)2 + M NiOOH + MH
NiOOH + MH
已知:6NiOOH + NH3 + H2O + OH- 6Ni(OH)2 + NO2-。
6Ni(OH)2 + NO2-。
下列说法正确的是
A.NiMH 电池放电过程中,正极的电极反应式为:NiOOH + H2O + e- Ni(OH)2 + OH- Ni(OH)2 + OH- |
| B.充电过程中OH-离子从阳极向阴极迁移 |
C.充电过程中阴极的电极反应式:H2O + M + e- MH + OH-,H2O中的H被M还原 MH + OH-,H2O中的H被M还原 |
| D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液 |