在盛有AgNO3、HCl、Na2CO3、CaCl2、NaCl、KCl六种无色溶液的试剂瓶上分别贴有①~⑥的编号,分别取它们两两混合,产生的现象如下表所列(其中“↑”表示产生气体,“↓”表示生成沉淀,“—”表示无现象):
| |
① |
② |
③ |
④ |
⑤ |
⑥ |
| ① |
|
— |
— |
↓ |
↓ |
↑ |
| ② |
— |
|
— |
— |
↓ |
— |
| ③ |
— |
— |
|
— |
↓ |
— |
| ④ |
↓ |
— |
— |
|
↓ |
— |
| ⑤ |
↓ |
↓ |
↓ |
↓ |
|
↓ |
| ⑥ |
↑ |
— |
— |
— |
↓ |
|
(1)推断下列编号对应的溶液(写溶质的化学式):
①_______,④_______,⑤________,⑥________。
(2)向①与⑤反应后的生成物中加入足量HNO3溶液,反应的离子方程式为__________________。
(3)通过以上实验,还有两种溶液不能确定,若要进一步确定它们,必须进行的实验是________________
除去下列物质中的杂质,写出发生反应的离子方程式:
(1)硝酸钾中混有溴化钾___________
(2)碳酸氢钾溶液中混有碳酸钾___________,
(3)二氧化碳气体中混有氯化氢气体___________。
(3分)在含有Al3+、Ba2+、Fe3+三种离子的混合溶液中只加一种试剂达到下列目的。所给的备选试剂有:氨水、NaOH溶液、H2SO4溶液、AgNO3溶液、Na2CO3溶液
(1)只让Ba2+离子沉淀完全,应加入________________;
(2)要让Al3+、Fe3+两种离子沉淀完全,应加入_________________;
(3)使三种离子全部转化为沉淀,应加入__________________________。
除去下列物质中所含有的杂质(括号内为杂质),将选用的试剂及分离方法填在题后的横线上,涉及化学反应的并写出有关反应的化学方程式(是离子反应的,写出其离子方程式)。
(1)Fe2O3[Fe(OH)3]____ ____,______ ____________;
(2)FeCl3溶液(FeCl2)____ ____,_______ _______________;
(3)Fe(Al) ___,__ _____________________。
(4)CO2(SO2) , 。
(5)SiO2(Al2O3) , 。
(6)淀粉溶液(氯化钠) 。
(7)KNO3(NaCl) 。
(8)Br2(H2O) 。
(12分)含有下列离子的五种溶液①Ag+ ②Mg2+ ③Fe2+ ④Al3+ ⑤Fe3+试回答下列问题:
(1)既能被氧化又能被还原的离子是________(填离子符号,下同)。
(2)向③中加入NaOH溶液,现象是_____________ _________________,
有关方程式(是离子反应的写离子方程式)为______ ____________。
(3)加入过量NaOH溶液无沉淀的是_____________。
(4)加入铁粉若溶液质量增重的是______ _,若溶液质量减轻的是_______________。
(5)遇KSCN溶液呈红色的是______________。
(6)能用来鉴别Cl-存在的离子是_______________。
(10分)化学学习中要注重对过程的分析,按要求回答下列问题:
(1)向石蕊试剂中通入氯气,起始时溶液变红,一段时间后溶液褪色,则使溶液变红和褪色的微粒分别是__________、_________。
(2)将一小块钠投入到盛氯化铵的溶液中,有氨气生成,其反应过程分为两步,其中第二步反应的离子方程式为__________。
(3)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液到中性,写出发生反应的离子方程式________________;在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式________。
按要求写出下列反应的方程式
(1)工业用石英制取粗硅的反应方程式:_______________________________;
(2)工业用赤铁矿做原料炼铁的反应方程式: ;
(3)金属铝与NaOH溶液反应的离子方程式:_______________________________;
(4)FeSO4溶液中滴加双氧水的离子方程式: ;
(5)酸性条件下, MnO4—被SO2还原为Mn2+的离子方程式:___________________________;
在烧杯中盛有半杯的Ba(OH)2溶液,然后用滴管向烧杯中滴加H2SO4(装置如图)。随着硫酸的滴入,电灯会逐渐变暗,当两者恰好完全反应时,电灯完全熄灭。
(1)该实验说明溶液的导电性与_________________有关。
(2)上述反应的离子方程式为_________________________________________。
(3)可以利用上述原理进行溶液浓度的测定。若烧杯中装有75mL 0.1mol/L Ba(OH)2溶液,当滴入25mL H2SO4时,电灯完全熄灭。试求该硫酸溶液的物质的量浓度为
22、写出下列物质反应的离子方程式为
(1)HCl与Na2CO3:____________ ____________;
(2)HCl与AgNO3:____________ ______________。
以铬铁矿(主要成分是FeO·Cr2O3,含少量MgCO3、Al2O3、SiO2等)为原料制取铬酸钠(Na2CrO4)晶体的工艺流程如下:
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO2-形式存在且易氧化;
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
(1)流程中两次使用了H2O2,分别写出反应的离子方程式:
__________________________________、____________________________________。
(2)加入NaOH调节溶液的pH=8时,被除去的离子是________;调节溶液的pH>11时,被除去的离子是________。
(3)“调pH=8”和“调pH>11”中间的“过滤”步骤能否省略,为什么?请用必要的文字和离子方程式解释:_______________________________________________________。
(4)流程图中“□”内的操作是___________________、______________________、 。
钛酸钡粉体是电子陶瓷元器件的重要基础原料。工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧可获得钛酸钡粉体。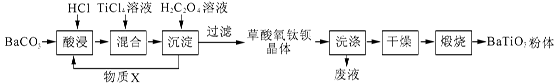
(1)酸浸时发生的反应的离子方程式为 ;为提高BaCO3的酸浸率,可采取的措施为 (任答一点)。
(2)配制TiCl4溶液时,通常将TiCl4溶于浓盐酸,目的是 。
(3)加入H2C2O4溶液时,发生反应的化学方程式为 ;
可循环使用的物质X是 。
(4)煅烧得到BaTiO3的同时,生成高温下的气体产物有CO、 和 。
下图是一些中学常见的物质之间的转化关系(其中部分反应产物省略),其中A和B常温下都是气体,且水溶液都有漂白性;I是一种金属单质;F、M、N均为难溶于水的白色沉淀,其中M和N不溶于稀硝酸;C和D是两种常见的强酸。请回答下列问题:
(1)写①的化学方程式______________________________________
(2)写反应②的离子方程式__________________________________
(3)写出将A通入石灰乳的化学方程式________________________
(4)在①②③④⑤⑥中,属于氧化还原反应的有:_______________(填编号)
利用化合价推测物质的性质是化学研究的重要手段。
(1)从化合价的角度可以预测物质的性质。
①SO2的性质________________(填序号,下同)
A.只有氧化性 B.只有还原性 C.既有还原性又有氧化性
②SO2通入酸性KMnO4溶液中,溶液由紫色褪至无色。反应后,锰元素被还原成Mn2+,写出上述反应的离子方程式_________________________________
(2)Fe(OH)2很不稳定,露置在空气中容易被氧化,发生反应的离子方程式为__________________________________________________为了获得白色的Fe(OH)2沉淀,可以用不含Fe3+的FeSO4溶液与不含O2的蒸馏水配置的NaOH溶液反应制备。
①用硫酸亚铁晶体配置上述硫酸亚铁溶液时,还需加入_________来防止Fe2+被氧化
②除去蒸馏水中溶解的O2常采用_______的方法
(3)检验Fe3+的方法:_______________________(写出加入试剂的化学式和现象与结论)
按要求写下列化学方程式(1)、(4)或离子方程式(2)(3)
(1)实验室用Ca(OH)2和NH4Cl制取氨气_______________________________
(2)过氧化钠粉末投入水中_____________________________________________
(3)向氯化铝溶液中加入足量氨水_______________________________________
(4)漂白粉在空气中变质_______________________________________________
化学与生产、生活密切相关。从化学视角回答下列问题:
(1)节日焰火利用的是 反应,城市射灯在夜空形成五颜六色的光柱,属于____效应,工业上制造光导纤维的基本原料是 。
(2)pH< 的雨水称为酸雨,我国形成酸雨的主要污染物是 。
(3)化工厂曾用浓氨水来检验氯气管道是否漏气,反应原理为(在有水蒸气存在时):2NH3+3Cl2==6HCl+N2。如果氯气管道某处漏气,用该方法检查时的现象是___________。
(4)碳酸氢铵俗称碳铵,是一种廉价氮肥,它的最大缺点是 。如果向碳酸氢铵溶液中滴加NaOH溶液至过量,反应的离子方程式是_____________________。