辽宁省实验分校高一上学期期末化学(理)试卷
下列事实与胶体知识有关的是
①用盐卤点豆腐;②生产出果冻;③用明矾净水;④河海交汇处可沉积成沙洲;
⑤初冬凌晨的迷雾的形成
| A.①②③ | B.②③④ | C.①③⑤ | D.全部都是 |
研究表明:多种海产品如虾、蟹、牡蛎等,体内含有+5价的砷(As)元素,但它对人体是无毒的,砒霜的成分是As2O3,属剧毒物质,专家忠告:吃饭时不要同时大量食用海鲜和青菜,否则容易中毒,并给出了一个公式:大量海鲜+大量维生素C=砒霜。下面有关解释不正确的是
| A.维生素C能将+5价砷氧化成As2O3 |
| B.维生素C具有还原性 |
| C.青菜中含有维生素C |
| D.生成砒霜的过程中砷元素发生氧化反应 |
N2O是一种有甜味、能溶于水、能助燃的无色气体,它能刺激神经使人发笑,俗称“笑气”;它具有麻醉作用,曾用作牙科麻醉剂。现有等物质的量的笑气和二氧化碳,下列数值不一定相同的是
| A.分子数 | B.电子数 | C.原子数 | D.质量 |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA |
| B.22.4L CO2与过量的Na2O2反应,转移的电子数为NA |
| C.物质的量浓度为0.3mol/L的BaCl2溶液中,含有Cl-个数为0.6 NA |
| D.3mol NF3(F元素为-1价)与水完全反应生成HF、HNO3和NO,转移电子数2NA |
硅及其化合物的应用范围很广。下列说法正确的是
| A.硅是人类将太阳能转换为电能的常用材料 |
| B.粗硅制备单晶硅不涉及氧化还原反应 |
| C.水泥、水晶和餐桌上的瓷盘都是硅酸盐制品 |
| D.盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅 |
下列表示对应化学反应的离子方程式正确的是
| A.漂白粉露置在空气中失效:ClO-+CO2+H2O=HClO+HCO3- |
| B.向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
C.碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+ Ca2++2H2O+2CO2↑ Ca2++2H2O+2CO2↑ |
| D.强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3= FeO42-+3Cl-+H2O+4H+ |
下列各组物质中,不满足组内任意两种物质在一定条件下均能发生反应的是
 物质 物质组别 |
甲 |
乙 |
丙 |
| A |
Mg |
FeSO4 |
O2 |
| B |
Al2O3 |
HCl |
NaOH |
| C |
CO2 |
H2O |
Na2O2 |
| D |
NaHCO3 |
Ca(OH)2 |
Na2CO3 |
①2K2CrO4+H2SO4=K2Cr2O7+K2SO4+H2O,
②K2Cr2O7+6FeSO4+7H2SO4=3Fe2(SO4)3+Cr2(SO4)3+K2SO4+7H2O,
③Fe2(SO4)3+2HI=2FeSO4+I2+H2SO4。
下列结论正确的是
| A.①②③均是氧化还原反应 |
| B.氧化性强弱顺序是K2Cr2O7>Fe2(SO4)3>I2 |
| C.反应②中氧化剂与还原剂的物质的量之比为6:1 |
| D.反应③中0.1mol还原剂共失去电子数为6.02×1023 |
下列各组离子在指定条件下,一定能大量共存的是
| A.pH=1的无色溶液:Na+、Cu2+、NO3-、SO42- |
| B.能使碘化钾淀粉试纸变蓝的溶液:K+、Fe2+、SO42-、Cl- |
| C.在含大量Fe3+ 的溶液中:NH4+、Na+、Cl-、NO3- |
| D.能溶解Al(OH)3固体的溶液:K+、Na+、HCO3-、NO3- |
有五种化合物:①Mg(HCO3)2,②Al(OH)3,③Al,④(NH4)2CO3,⑤Al2O3。跟盐酸和NaOH溶液都能反应的物质有
| A.二种 | B.三种 | C.四种 | D.五种 |
将金属铜、铁置于氯化铁溶液中充分反应,下列对反应情况设想的评价正确的是
| 选项 |
反应情况设想 |
评价 |
| A |
当铁、铜均不剩余时,溶液中一定有Fe2+、Cu2+,一定无Fe3+ |
正确,Fe3+和Fe、Cu均可反应 |
| B |
当铁、铜均有剩余时,溶液中一定有Fe2+、Cu2+,无Fe3+ |
正确,Fe和Cu与Fe3+都反应,故有Fe2+和Cu2+,无Fe3+ |
| C |
当铜有剩余,铁无剩余时,溶液中一定只有Fe2+,无Cu2+ |
正确,Cu有剩余,故无Cu2+ |
| D |
当铁有剩余,铜无剩余时,溶液中一定有Fe2+、Cu2+ |
不正确,不可能有Fe剩余,而铜不剩余,因为Fe比Cu优先于Fe3+反应 |
下列叙述正确的是
| A.向含CaCO3沉淀的水中通入CO2至沉淀恰好溶解,再向溶液中加入NaHCO3饱和溶液,又有CaCO3沉淀生成 |
| B.向Na2 CO3溶液中逐滴加入含等物质的量HCl的稀盐酸,生成的CO2与原Na2 CO3的物质的量之比为1:2 |
| C.等质量的NaHCO3和Na2 CO3分别与足量盐酸反应,在同温同压下,生成的CO2体积相同 |
| D.向Na2 CO3饱和溶液中通入CO2有NaHCO3结晶析出 |
下列现象或事实不能用同一原理解释的是
| A.浓硝酸和氯水用棕色试剂瓶保存 |
| B.硫化钠和亚硫酸钠固体长期暴露在空气中变质 |
| C.常温下铁和铂都不溶于浓硝酸 |
| D.SO2和Na2SO3溶液都能使氯水褪色 |
假设SiO2原子晶体中Si原子被Al原子取代,不足的价数由K原子补充。当有25%的硅原子被铝原子取代时,可形成正长石,则正长石的化学组成为
| A.KAlSiO4 | B.KAlSi2O6 | C.KAlSi3O8 | D.KAlSi4O10 |
对水的处理包括水的净化、软化、杀菌消毒、去离子、蒸馏等。其中常见的杀菌消毒剂包括氯气、臭氧、漂粉精、活性炭等。2008年北京奥运会拟用臭氧、活性炭对游泳池进行消毒和净化。下列说法中不正确的是
| A.臭氧、活性炭处理水的原理相同 |
| B.由于氯气能和水中的有机物反应,生成含氯化合物,因而不是理想的水处理剂 |
| C.漂粉精长期露置在空气中会失效 |
| D.臭氧和氯气都具有强氧化性 |
由NO、H2、CO2组成的混合气体,通过足量的Na2O2充分反应后,再用电火花引燃使其充分反应后,最终只得到质量分数为70%的硝酸,无其他气体剩余。则原混合气体中NO、H2、CO2的体积比
| A.2:4:7 | B.2:4:5 | C.2:4:3 | D.3:5:8 |
某混和气体可能含有H2、CO、CO2、HCl、NH3和水蒸气中的两种或多种,当混和气体依次通过:①澄清石灰水(无浑浊现象);②氢氧化钡溶液(有浑浊现象);
③浓H2SO4(无现象);④灼热氧化铜(变红);⑤无水硫酸铜(变蓝)。(假设每一次吸收均完全)。对该混和气体成分判断正确的是
| A.一定没有CO2,肯定有H2 |
| B.一定有CO、CO2和水蒸气 |
| C.一定有H2、CO2和HCl |
| D.可能有CO2、NH3和水蒸气 |
在隔绝空气的情况下,9.2 g铁、镁、铝混合物溶解在一定量某浓度的稀硝酸中,当金属完全溶解后收集到4.48 L(标准状况下)NO气体。在反应后的溶液中加入足量的烧碱溶液,可生成氢氧化物沉淀的质量为
| A.18.6 g | B.20 g | C.19.4 g | D.24 g |
在1 L溶液中含有Fe(NO3)3和H2SO4两种溶质,其浓度分别为0.2 mol•L-1和1.5mol•L-1,现向该溶液中加入39.2 g铁粉使其充分反应。下列有关说法正确的是
| A.反应后溶液中Fe3+物质的量为0.8 mol |
| B.反应后产生13. 44 L H2(标准状况) |
| C.反应后溶液中Fe2+和Fe3+物质的量之和为0.9 mol |
| D.由于氧化性Fe3+>H+,故反应中先没有气体产生后产生气体 |
a、b、c、d、e是含有一种相同元素的五种物质,可发生如下转化:
其中:a是单质;b是气体且为含氢化合物;c、d是氧化物;e是最高价含氧酸。
(1)如果a是一种淡黄色粉末固体,试推断:(用化学式表示):
a ;b ;e 。写出由c生成d的化学方程式____________________________
(2)如果a为单质且是一种常见气体,试推断这五种物质(用化学式表示):
a ;b ;c ;并写出由d生成e的化学方程式________________________
(10分)化学学习中要注重对过程的分析,按要求回答下列问题:
(1)向石蕊试剂中通入氯气,起始时溶液变红,一段时间后溶液褪色,则使溶液变红和褪色的微粒分别是__________、_________。
(2)将一小块钠投入到盛氯化铵的溶液中,有氨气生成,其反应过程分为两步,其中第二步反应的离子方程式为__________。
(3)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液到中性,写出发生反应的离子方程式________________;在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式________。
下列框图所示的转化关系中,A、C均为常见的金属单质,A、C在冷的H的浓溶液中均会发生钝化;E为固体非金属单质。B为红色固体氧化物,X为常见的无色液体。L焰色为黄色,且能使酚酞变红(反应过程中生成的水及其他产物已略去)
请回答以下问题:
(1)含碳量在0.03 %~2 %之间的C的合金,是目前世界上使用量最大的合金,这种合金是 ;
A.铝合金 B.青铜 C.镁合金 D.钢铁
(2)F的化学式为 ;
(3)I与氯气反应的离子方程式为 ;
(4)A与B生成C和D的反应是 (填“放出”或“吸收”)大量热量的反应;
(5)D与L反应的离子方程式为 。
某研究性实验小组欲验证浓硝酸在与Cu、Ag合金的反应过程中除生成NO2气体外,还会有少量NO生成、并测定Cu、Ag合金中Cu的质量分数。查阅相关资料表明:“常温下,NO2与N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。”为此,他们设计了如下图所示的装置。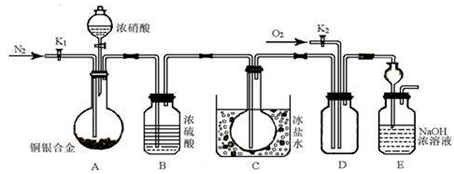
请回答下列问题
(1)写出A中Cu与HNO3反应可能的化学方程式 。
(2)实验开始前先打开A部分的活塞K1,持续通入一段时间的氮气再关闭K1,其目的是 ;装置中B瓶的作用是 。
(3)停止反应后,打开D中的活塞K2并通入O2,若有NO生成,则D中出现的现象是 。
(4)为减小实验误差,在A中反应完成和D中出现现象后,还应继续进行的操作是 。
(5)实验测得如下数据:实验前,Cu、Ag合金的质量:15.0g,浓HNO3:40mL 13.5 mol·L1;实验后A溶液:V=40mL c(H+)=1.0 mol·L1。假设反应中HNO3既无挥发也无分解,则:参加反应的HNO3的物质的量
为 mol。
(6)若已知Cu、Ag合金的质量为m g,且溶解完全。请利用A装置中反应后的溶液进行简单的操作,以确定合金中Cu的质量分数,其实验过程为 。
 粤公网安备 44130202000953号
粤公网安备 44130202000953号