钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:
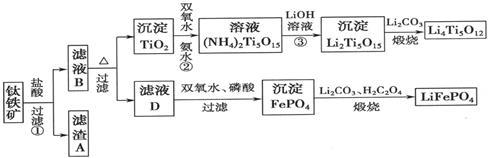
已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl—= Fe2++ TiOCl42—+2H2O
(1)化合物FeTiO3中铁元素的化合价是___________。
(2)滤渣A的成分是___________。
(3)滤液B中TiOCl42-和水反应转化生成TiO2的离子方程式是 。
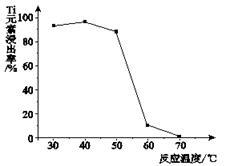
(4)反应②中固体TiO2转化成(NH4)2Ti5O15 溶液时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti元素浸出率下降的原因 。
(5)反应③的化学方程式是 。
(6)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是___________。
(7)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)作电极组成电池,其工作原理为:Li4Ti5O12 + 3LiFePO4 Li7Ti5O12 + 3FePO4 该电池充电时阳极反应式是: 。
Li7Ti5O12 + 3FePO4 该电池充电时阳极反应式是: 。
近年来,我国的电子工业迅速发展,造成了大量的电路板蚀刻废液的产生和排放.蚀刻液主要有酸性的(HCl-H2O2)、传统的FeCl3型(HCl-FeCl3)等方法。蚀刻废液中含有大量的Cu2+,废液的回收利用可减少铜资源的流失。几种蚀刻废液的常用处理方法如下:
(1)FeCl3型酸性废液用还原法处理是利用Fe和Cl2分别作为还原剂和氧化剂,可回收铜并使蚀刻液再生。发生的主要化学反应有:Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑,还有__________、__________(用离子方程式表示).
(2)HCl-H2O2型蚀刻液在蚀刻电路板过程中发生的化学反应用化学方程式可表示为:______________。
(3)处理H2O2型酸性废液回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是______________.
盛放NaOH溶液的试剂瓶不能用玻璃塞,是为了防止发生反应(用离子方程式表示)________,避免瓶口与瓶塞粘在一起。
(1)FeCl3溶液呈________(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):_______________________;实验室在配制FeCl3溶液时,常将FeCl3固体先溶于较浓的盐酸中,_____________(填“促进”、“抑制”)其水解,然后再用蒸馏水稀释到所需的浓度。
(2)将氯化铝溶液蒸干灼烧得到的固体物质是 ;(填化学式,下同)将硫酸铝溶液蒸干得到的固体物质是 。
(1)下列有关硅单质及其化合物的说法正确的是 。
A.高纯度的硅单质广泛用于制作光导纤维
B.水泥、玻璃、陶瓷都是硅酸盐产品
C.自然界中的硅元素储量丰富,并存在大量的硅单质
D.SiO2属于酸性氧化物,故只与碱溶液发生化学反应,不与任何酸反应
(2)某些化学反应可用下式表示(未配平):A+B→C+D+H2O,请回答下列问题:
①若A、C、D均含有氯元素,且A中氯元素的化合价介于C与D之间,D具漂白性。
A. 写出该反应的离子方程式: 。
B. Mg(ClO3)2在农业上可用作脱叶剂、催熟剂,可采用复分解反应制备: MgCl2+2NaClO3=Mg(ClO3)2+2NaCl
MgCl2+2NaClO3=Mg(ClO3)2+2NaCl ,已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:
,已知四种化合物的溶解度(S)随温度(T)变化曲线如下图所示:



将反应物按化学反应方程式计量数比混合制备Mg(ClO3)2。简述可制备Mg(ClO3)2的原因: 。
②若A与B加热生成的产物C、D均为无色气体,且C、D两分子中组成元素的原子个数比都为1:2,则符合上式的化学方程式是: 。
③若A为过氧化钠,B为硫酸,则C、D的化学式为 、 。
某工业废水中含有大量的FeSO4、较多的Cu2+和少量的Fe3+。为了较少污染并变废为宝,拟从该废水中回收硫酸亚铁和金属铜,其流程如下图。请完成下列问题。
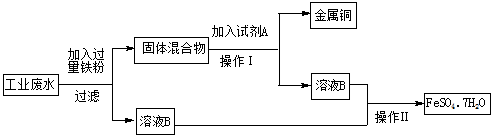
(1)检验工业废水中含有Fe3+的方法是 。
(2)工业废水中加入过量铁粉时,有Fe3+参加的离子反应方程式为 。
(3)操作Ⅰ为 。
硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
| 物质 |
熔点/℃ |
沸点/℃ |
其它性质 |
| SO2Cl2 |
-54.1 |
69.1 |
①易水解,产生大量白雾 ②易分解:SO2Cl2  SO2↑+Cl2↑ SO2↑+Cl2↑ |
| H2SO4 |
10.4 |
338 |
吸水性且不易分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:

(1)仪器A冷却水的进口为 (填“a”或“b”)。
(2)仪器B中盛放的药品是 。
(3)实验时,装置丁中发生反应的离子方程式为 。
(4)装置丙的作用为 ,若缺少装置乙,则硫酰氯会水解,该反应的化学方程式为 。
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4 + SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的方法是 。
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液): 。
常温下,将0.01 mol CH3COONa 和0.002 molHCl溶于水,形成1L混合溶液:
(1)该溶液中存在三个平衡体系,用电离方程式或离子方程式表示①和②:
① 。
② 。
③CH3COOH CHCOO-+H+。
CHCOO-+H+。
(2)溶液中共有 种不同的粒子(指分子和离子),在这些粒子中,浓度为0.01 mol/L的是 ,浓度为0.002 mol/L的是 。
(3)在上述溶液中,存在的两个守恒关系是:
①物料守恒,C(CH3COO-)+C(CH3COOH)= mol/L;
②电荷守恒,即: 。
在铝质易拉罐中收集满CO2气体,然后在其中倒入10mL浓NaOH溶液,并迅速用胶带将易拉罐口封住,能够观察到的实验现象是易拉罐突然变瘪了,可经过一段时间之后,又观察到的现象是_________。易拉罐变瘪的原因是__________________;产生后一现象的原因是__________________ 。写出反应过程中的两个离子方程式 ; 。
金属表面处理、皮革鞣制、印染等都可能造成铬污染。六价铬比三价铬毒性高,更易被人体吸收且在体内蓄积。
(1)工业上处理酸性含Cr2O72-废水的方法如下:
①向含Cr2O72-的酸性废水中加入FeSO4溶液,使Cr2O72-全部转化为Cr3+。写出该反应的离子方程式: 。
②调节溶液的pH,使Cr3+完全沉淀。实验室粗略测定溶液pH的方法为 。
(2)铬元素总浓度的测定:准确移取25.00mL含Cr2O72-和Cr3+的酸性废水,向其中加入足量的(NH4)2S2O8溶液将Cr3+氧化成Cr2O72-,煮沸除去过量的(NH4)2S2O8;向上述溶液中加入过量的KI溶液,充分反应后,以淀粉为指示剂,向其中滴加0.015mol/L的Na2S2O3标准溶液,终点时消耗Na2S2O3溶液20.00mL。计算废水中铬元素总浓度(单位:mg·L-1,写出计算过程)。
已知测定过程中发生的反应如下:
①2Cr3+ + 3S2O82-+ 7H2O=Cr2O72-+ 6SO42-+ 14H+
②Cr2O72-+ 6I-+ 14H+=2Cr3+ + 3I2 + 7H2O
③I2 + 2S2O32-=2I-+ S4O62-
已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:
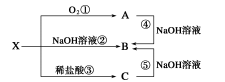
(1)写出下列物质的化学式:X ,A ,B C ;
(2)写出以下反应的离子方程式:
②
④
试样X由氧化亚铁和氧化铜组成,取质量相等的两份试样按图所示进行实验: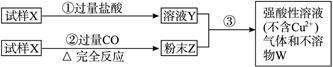
(1)请写出步骤③中所发生的全部反应的离子方程式。
(2)若全部的溶液Y和全部的粉末Z充分反应后,生成的不溶物W的质量是m,则每份试样X中氧化铜的质量为______________(用m表示)。
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是 (用离子方程式表示),FeCl3净水的原理是 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+) = 1.0 × 10-3 mol·L-1 , c(Cl-) = 5.3 × 10-2 mol·L-1,则该溶液的pH约为 。
②完成NaClO3氧化FeCl2的离子方程式:  Fe2++
Fe2++ ClO3-+
ClO3-+  =
=  Fe3++
Fe3++ Cl-+
Cl-+ 。
。
(3)FeCl3在溶液中分三步水解:
Fe3++H2O  Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是 (填序号)。
| A.加水稀释 | B.降温 | C.加入NH4HCO3 | D.加入NH4Cl |
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是 。
碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题。
(1)碳酸氢钠的化学式是___________,俗称____________,其水溶液显_______性(填“酸”、“碱”或“中”)。
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为_____________。等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者_________后者(填“>”、“<”或“=”)。
(3)除去碳酸钠固体中碳酸氢钠的反应的化学方程式为__________________________。
“探险队员”——盐酸,不小心走进了化学迷宫,迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。
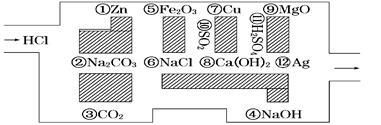
(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线)_____________。
(2)在不能“吃掉”盐酸的物质中,属于非电解质的是________(填写物质序号),在能“吃掉”盐酸的物质中,属于电解质的是 (填写物质序号)。
(3)如果将盐酸换成碳酸镁,它能沿着盐酸走出的路线“走出”这个迷宫吗?填“能”或“不能”_____,写出离子方程式说明其原因: 。
(4)写出氧化铝与④反应的化学方程式 ,氧化铝属于 ____________氧化物(填“酸性”“碱性”或“两性”)。