NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管,增强免疫和记忆的功能,而成为当前生命科学的研究热点,NO亦被称为“明星分子”。请回答下列问题。
(1)NO对环境的危害在于
| A.破坏臭氧层 | B.高温下能使一些金属氧化 |
| C.造成酸雨 | D.与人体血红蛋白结合 |
(2)在含Cu+ 离子的酶的活化中心中,亚硝酸根离子可转化为NO,写出Cu+ 和亚硝酸根离子在酸性水溶液中反应的离子方程式:___________________
现有五种离子化合物 A、B、C、D 和 E,组成它们的离子有:
| 阳离子 |
K+ Ag + Ba 2+ A13+ Fe3+ |
| 阴离子 |
OH - C1 - SO4 2- NO3- CO32- |
为鉴别它们,分别完成以下实验,其结果是:
a. B 和 E 的水溶液均呈碱性。
b. A 溶于水后,与上述某阳离子反应生成的白色沉淀X,X既不溶于氨水也不溶于硝酸,且 A 溶液与过量氨水反应生成白色沉淀Y;
c. C 溶液与适量氨水反应生成无色溶液可与葡萄糖溶液发生银镜反应。
d. E 溶于水后,与上述某阴离子反应可生成 X;
e. A溶液与适量 E溶液反应生成白色沉淀,再加入过量 E溶液,沉淀量减少,但不消失。 请根据上述实验结果,填空:
(1)写出化合物的化学式:A ,B ,C 。
⑵ 写出D与氨水反应的化学方程式:
⑶写出实验e中“A溶液与适量 E溶液反应生成沉淀”后“再加入过量 E溶液,
沉淀量减少”的离子方程式: 。
按照要求,回答下列问题
(1)写出下列物质熔融态的电离方程式:NaHSO4 。
(2)将粗盐溶解过滤除去不溶性杂质后,在滤液中依次滴加过量NaOH溶液、BaCl2溶液和Na2CO3溶液,直至不再产生沉淀。滴加Na2CO3溶液时发生反应的化学方程式为 。
(3)写出制备Fe(OH)3胶体的化学方程式:__________ __。取乙烧杯中少量Fe(OH)3胶体置于试管中,向试管中逐渐滴加稀盐酸至过量,发生此变化的离子方程式为_______________。
由氯化铁溶液制备胶体的化学方程式为_______________________________.
写出下列反应的离子方程式。
①硫酸与氢氧化钡溶液反应的离子方程式:_________________________________________
②足量稀盐酸与碳酸氢钠溶液反应的离子方程式:______________________________________
③向足量的氢氧化钙溶液中通入二氧化碳的离子方程式:
④稀硫酸清洗铁锈(Fe2O3)的离子方程式:
只选用一种试剂鉴别NaNO3、Ba(HCO3)2、BaCl2、Na2CO3四瓶无色溶液,应选用
做试剂,有关的离子方程式是
⑴
⑵
⑶
在铝质易拉罐中收集满CO2气体,然后在其中倒入10mL浓NaOH溶液,并迅速用胶带将易拉罐口封住,能够观察到的实验现象是易拉罐突然变瘪了,可经过一段时间之后,又观察到的现象是_________。易拉罐变瘪的原因是__________________;产生后一现象的原因是__________________ 。写出反应过程中的两个离子方程式 ; 。
(每小题3分,共15分)
(1)实验室制取氯气反应的离子方程式为
(2)工业上制取漂白粉反应的化学方程式为
(3)配平: KClO3+ H2C2O4+ H2SO4 → K2SO4+ ClO2↑+ CO2↑+ H2O
(4)二氧化碳气体通过一定量的过氧化钠固体,固体增重2.8g时,放出热量为Q KJ
则此反应的热化学方程式为
(5)标况下3.136 L Cl2通入0.1 L FeBr2溶液中,测得溶液Br-中消耗了三分之二,则此时总反应的离子方程式为
(6分)根据题目要求书写化学用语
(1)写出符合SO42—+ Ba2+= BaSO4↓的化学方程式
(2)写出实验室制二氧化碳的离子方程式
(3)氯水滴入硝酸银溶液的化学方程式
已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:
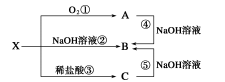
(1)写出下列物质的化学式:X ,A ,B C ;
(2)写出以下反应的离子方程式:
②
④
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是 (用离子方程式表示),FeCl3净水的原理是 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+) = 1.0 × 10-3 mol·L-1 , c(Cl-) = 5.3 × 10-2 mol·L-1,则该溶液的pH约为 。
②完成NaClO3氧化FeCl2的离子方程式:  Fe2++
Fe2++ ClO3-+
ClO3-+  =
=  Fe3++
Fe3++ Cl-+
Cl-+ 。
。
(3)FeCl3在溶液中分三步水解:
Fe3++H2O  Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是 (填序号)。
| A.加水稀释 | B.降温 | C.加入NH4HCO3 | D.加入NH4Cl |
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是 。
碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题。
(1)碳酸氢钠的化学式是___________,俗称____________,其水溶液显_______性(填“酸”、“碱”或“中”)。
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为_____________。等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者_________后者(填“>”、“<”或“=”)。
(3)除去碳酸钠固体中碳酸氢钠的反应的化学方程式为__________________________。
“探险队员”——盐酸,不小心走进了化学迷宫,迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。
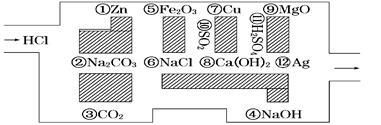
(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线)_____________。
(2)在不能“吃掉”盐酸的物质中,属于非电解质的是________(填写物质序号),在能“吃掉”盐酸的物质中,属于电解质的是 (填写物质序号)。
(3)如果将盐酸换成碳酸镁,它能沿着盐酸走出的路线“走出”这个迷宫吗?填“能”或“不能”_____,写出离子方程式说明其原因: 。
(4)写出氧化铝与④反应的化学方程式 ,氧化铝属于 ____________氧化物(填“酸性”“碱性”或“两性”)。
(1)PH=10的Na2CO3溶液、NaOH溶液和PH=4的NH4Cl溶液、HCl溶液中水的电离程度的大小关系是 。(用化学式表示)
(2)对于Ag2S(s)  2Ag+(aq)+ S2-(aq),其Ksp=____________。
2Ag+(aq)+ S2-(aq),其Ksp=____________。
(3)NH4HSO4的电离方程式为