下列离子方程的书写及评价均合理的是( )
| 选项 |
离子方程式 |
评价 |
| A |
将2mol Cl2通入到含1mol FeI2的溶液中: 2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 |
正确;Cl2过量,可将Fe2+、I-均氧化 |
| B |
Mg(HCO3)2溶液与足量的NaOH溶液反应: Mg2++HCO3-+OH-=MgCO3↓+H2O |
正确;酸式盐与碱反应生成正盐和水 |
| C |
过量SO2通入到NaClO溶液中: SO2+H2O+ClO-=HClO+HSO3- |
正确;说明酸性: H2SO3强于HClO |
| D |
1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积互相均匀混合:2AlO2-+5H+=Al3++Al(OH)3↓+H2O |
正确;AlO2-与Al(OH)3消耗的H+的物质的量之比为2:3 |
在下列给定条件的溶液中,一定能大量共存的离子是
| A.滴加甲基橙试剂显红色的溶液中:Na +、Fe 2+、Cl-、NO3- |
| B.由水电离的c(H+)=1.0×10-13 mol·L﹣1的溶液中:K +、Na +、AlO2-、CO32- |
| C.常温下,pH="7" 溶液中:NH4+、Al3+、NO3-、CO32- |
| D.KW/c(H+)=0.1 mol·L-1的溶液:Na+、K+、SiO32-、NO3- |
下列反应的离子方程式中正确的是
| A.向等物质的量浓度的NaOH和Na2CO3的混合液中加入一定量的稀盐酸:2OH-+CO32-+4H+=CO2↑+2H2O |
| B.Ca(HCO3)2溶液中滴加少量NaOH溶液:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- |
| C.向Fe(OH)2中加入稀硝酸:3Fe2++4H++NO3-=3Fe3++ NO↑+ 2H2O |
| D.向AlCl3溶液中滴加过量氨水:Al3++3NH3·H2O = Al(OH)3↓+ 3NH4+ |
下列表示对应化学反应的离子方程式正确的是( )
| A.Na2O2溶于水产生O2: 2O22-+2H2O=O2↑+4OH- |
| B.向氨水通入足量SO2:SO2十2NH3·H2O=2NH4++SO32-+H2O |
| C.次氯酸钠与浓盐酸反应产生Cl2:ClO-+Cl-+H2O=Cl2↑+2OH- |
| D.NaHCO3溶液与少量Ba(OH)2溶液反应:Ba2++2OH-+2HCO3-=BaCO3↓+CO32-+2H2O |
Ⅰ、碳元素是日常生活中接触非常多的一种元素,回答下列问题。
(1)用化学方程式表示溶洞生成的反应原理: 。
(2)可用稀盐酸来鉴别Na2CO3和NaHCO3溶液,现将稀盐酸慢慢滴入碳酸钠溶液中,请写出开始阶段发生反应的离子方程式 。
(3)写出用小苏打来治疗胃酸过多时发生反应的离子方程式: 。
II、氮元素在生命活动中扮演着重要的角色,回答下列与氮及其化合物有关的问题:
(1)德国化学家哈伯、波施等科学家成功地开发了将氮气转化为氨气的生产工艺。请用化学方程式表示工业合成氨的反应原理: 。
写出在氨气的出气口处,检验有氨气生成的操作:
(2)将氨气通入酚酞溶液中,酚酞溶液变成红色。请用方程式解释原因: 。
Ⅲ、印刷电路板是由塑料和铜箔复合而成,刻制印刷电路时要用FeCl3溶液作为“腐蚀液”溶解铜。
(1)写出该反应的离子方程式: ;
(2)从使用过的腐蚀液中可以回收金属铜,下列试剂能实现的是 (填序号)
| A.氯气 | B.铁 | C.硝酸 | D.稀硫酸 |
(3)向使用过的腐蚀液中通入Cl2,可使Fe2+转化为Fe3+,写出反应的离子方程式 。
下列反应的离子方程式正确的是
| A.FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
| B.硫酸亚铁溶液中加过氧化氢溶液:Fe2++2H2O2+4H+=Fe3++4H2O |
| C.用氨水吸收少量二氧化硫:NH3·H2O+SO2=NH4++HSO3- |
| D.硝酸铁溶液中加过量氨水:Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+ |
能正确表示下列反应的离子方程式是
A.硫氢化钠的水解反应 HS-+ H2O  S2-+H3O+ S2-+H3O+ |
| B.碳酸氢钙与过量的 NaOH 溶液反应 Ca2++2HCO3-+2OH-= CaCO3↓+2H2O+CO32- |
| C.Na2O2与H2O反应制备O2 Na2O2 + H2O = 2Na+ + 2OH-+ O2↑ |
| D.向碳酸钠溶液中加少量盐酸 CO32-+2H+ = H2O+CO2↑ |
肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O):CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl。
实验一:制备NaClO溶液
(1)将氯气通入到盛有NaOH溶液的锥形瓶中,锥形瓶中发生反应的离子方程式为________________。
实验二:制取水合肼(实验装置如图所示)
控制反应温度,将分液漏斗中的溶液缓慢滴入三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114 ℃馏分。(已知:N2H4·H2O+2NaClO===N2↑+3H2O+2NaCl)
(2)仪器X的名称是___________;分液漏斗中的溶液是___________(填“A”或“B”);
A.NaOH和NaClO混合溶液
B.CO(NH2)2溶液
选择的理由是_____________________________。
实验三:测定馏分中水合肼的质量分数
水合肼具有还原性,被氧化生成氮气。测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000 g,加入适量NaHCO3固体,经稀释、转移、定容等步骤,配制250 mL溶液。
b.移取25.00 mL溶液于锥形瓶中,加入10 mL水,摇匀。
c.用0.2000 mol·L-1碘溶液滴定至溶液出现微黄色且半分钟内不消失,滴定过程中,溶液的pH保持在6.5左右。记录消耗碘的标准溶液的体积。
d.进一步操作与数据处理。
(3)水合肼与碘溶液反应的化学方程式为_________________________________;
测定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是______________________。
(4)滴定时,碘的标准溶液盛放在___________(填“酸式”或“碱式”)滴定管中;若三次滴定消耗碘的标准溶液的平均体积为18.00 mL,则馏分中水合肼(N2H4·H2O)的质量分数为________(保留三位有效数字)。
下列各组离子或分子能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是
| 选项 |
离子组 |
加入试剂 |
加入试剂后发生反应的离子方程式 |
| A |
NH4+、Fe2+、SO42- |
少量Ba(OH)2溶液 |
2NH4++SO42-+Ba2++2OH-===BaSO4↓+2NH3·H2O |
| B |
Mg2+、HCO3-、Cl- |
过量NaOH溶液 |
Mg2++2HCO3-+4OH-=== 2H2O+Mg(OH)2↓+2CO32- |
| C |
K+、NH3·H2O、CO32- |
通入少量CO2 |
2OH-+CO2===CO32-+H2O |
| D |
Fe2+、NO3-、SO32- |
NaHSO4溶液 |
SO32-+2H+===SO2↑+H2O |
下列离子方程式正确的是
| A.向含有Fe2O3悬浊液中通入HI:Fe2O3 + 6H+ = 2Fe3++ 3H2O |
| B.NaHSO4溶液中滴入Ba(OH)2溶液至SO42-完全沉淀: 2H++ SO42-+Ba2++2OH—= BaSO4↓+2H2O |
| C.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2↑ |
| D.将1 mol/L NaAlO2溶液和1.5 mol/L的 HCl溶液等体积互相均匀混合: |
6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+
向FeI2和FeBr2、氯气的物质的量之比为1:1:2的混合溶液中,发生的离子反应是( )
| A.2Fe2++4I-+3Cl2===2Fe3++2I2+6Cl- |
| B.2Fe2++4I-+4Br-+5Cl2===2Fe3++2I2+2Br2+10Cl- |
| C.2Fe2++2I-+2Br-+3Cl2===2Fe3++I2+Br2+6Cl- |
| D.2Fe2++2I-+2Cl2===2Fe3++I2+4Cl- |
Ⅰ.请回答:
(1)燃着的钠不能用CO2灭火,其理由 (用化学方程式表示)。
(2)完成以下氧化还原反应的离子方程式:
( )Fe3++( )ClO-+______=( )FeO42-+( )Cl-+( )H2O
(3)剧毒物氰化钠的电子式为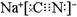 ,碳元素的化合价为 ;用ClO2处理泄漏的氰化钠,得到无毒的NaCl、N2和CO2。若处理4×10-5mol·L-1的废水1000L,至少需要ClO2的质量为 g。
,碳元素的化合价为 ;用ClO2处理泄漏的氰化钠,得到无毒的NaCl、N2和CO2。若处理4×10-5mol·L-1的废水1000L,至少需要ClO2的质量为 g。
II.化合物A是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:
A(s)+H2(g)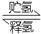 B(s)+LiH(s) ΔH= -44.5kJ•mol-1……①
B(s)+LiH(s) ΔH= -44.5kJ•mol-1……①
已知:①在液氨中加入金属锂生成B和氢气;
②一定条件下,2.30g固体B与5.35gNH4Cl固体恰好完全反应,生成固体盐C和4.48L气体D (已折算成标准状况);气体D能使湿润的红色石蕊试纸变蓝色。
(1)A的化学式为 ,LiH中r(Li+) r(H-)(填“大于”或“小于”)。
(2)写出液氨与金属锂反应的化学方程式 。
(3)B在加强热时生成NH3和另一种化合物E,该分解反应的化学方程式为 。
(4)化合物E也可以作储氢材料,其储氢原理可表示为:
E(s)+H2(g)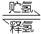 A(s)+LiH(s) ΔH= -165kJ·mol-1…………②
A(s)+LiH(s) ΔH= -165kJ·mol-1…………②
储氢材料可以通过加热的方式释放氢气。从实用化角度考虑,选择 (填“A”或“E”)作储氢材料更合理,理由是 。
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。(已知25℃Ksp[Fe(OH)3]=4.0×10﹣38 lg2=0.3)
请回答下列问题:
(1)FeCl3净水的原理是____________ 。(用离子方程式表示),Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,常温下此反应的平衡常数为_________________(填写数值)。
(2)将FeCl3溶液与NaHCO3 溶液混合,其离子方程式为 _______________。
(3)25℃时pH=3的溶液中,c(Fe3+)= mol•L﹣1要使Fe3+ 沉淀完全,pH应大于________。
(4)FeCl3在溶液中分三步水解:
Fe3++H2O  Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。
通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:
xFe3++yH2O Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
(5) FeCl3溶液可腐蚀印刷电路板,其反应为Cu +2FeCl3=CuCl2+2FeCl2 要将此反应设计在原电池中进行,则正极反应式为__________。
用含有Al2O3、SiO2和少量FeO·xFe2O3的铝灰制备Al2(SO4)3·18H2O,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤;
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色;
Ⅳ.加入MnSO4至紫红色消失,过滤;
Ⅴ..再经过一系列操作,分离得到产品。
(1)步骤Ⅰ中过滤所得滤渣主要成分为:______________________,H2SO4溶解Al2O3的离子方程式为:______________________。
(2)步骤Ⅱ中加入KMnO4时发生反应的离子方程式为:_______________________。
(3)已知:生成氢氧化物沉淀的pH
| |
Al(OH)3 |
Fe(OH)2 |
Fe(OH)3 |
| 开始沉淀时 |
3.4 |
6.3 |
1.5 |
| 完全沉淀时 |
4.7 |
8.3 |
2.8 |
注:金属离子的起始浓度均为0.1 mol·L-1
①根据表中数据解释步骤Ⅱ的目的:__________________________,
②当Al3+开始沉淀时,Fe3+的浓度约为:_______________________。
(4)已知:一定条件下,MnO4-可与Mn2+反应生成MnO2。
①向Ⅲ的沉淀中加入浓盐酸并加热,能说明沉淀中存在MnO2的现象是: 。
②步骤Ⅳ中加入MnSO4的目的是: 。
(5)步骤Ⅴ中“一系列操作”是________________________、________________________。