下列指定反应的离子方程式正确的是
| A.硫酸镁溶液与氢氧化钡溶液反应:SO42-+Ba2+=BaSO4↓ |
| B.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合 Ba2++2OH-+NH4++HCO3-=BaCO3↓+NH3•H2O+H2O |
C.惰性电极电解MgCl2溶液:2Cl-+2H2O H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
| D.次氯酸钙溶液中通入少量的二氧化碳:2ClO-+CO2+H2O=CO32-+2HClO |
已知四种强电解质溶液,分别含有下列阴、阳离子中的各一种,并且互不重复:Ba2+、H+、K+、NH4+、CO32-、Cl-、OH-、SO42-.将这4种溶液分别标记为A、B、C、D,其相互关系如下:
①向A或D中滴入C,均生成白色沉淀;
②A和B混合加热产生的气体能被D吸收;
③A和D反应生成的气体能被B吸收。
请回答下列问题:
(1)A、B、C、D中电解质的化学式:
A________、B、________C、________D________。
(2)若将B和D混合,反应的离子方程式为______________________。
(3)若将③中生成的气体用过量的B吸收,则反应的离子方程式为___________________。
向Ba(OH)2溶液中逐滴加入稀硫酸,请完成下列问题:
(1)写出反应的离子方程式________________________;
(2)下列四种情况下,离子方程式与(1)相同的是_____________(填序号)
| A.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量 |
| B.向Ba(OH)2溶液中,逐滴加入NaHSO4溶液至Ba2+恰好完全沉淀 |
| C.向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至溶液显中性 |
| D.向Ba(OH)2溶液中,逐滴加入NaHSO4溶液至过量 |
(3)若缓缓加入稀H2SO4直至过量,整个过程中混合溶液中的导电能力(用电流强度I表示)可近似地用如图中的曲线表示是_______(填序号)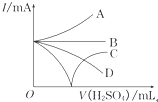
(4)向Ba(OH)2溶液中加入密度为1.165g/cm3的硫酸溶液,直到恰好完全反应为止,已知所生成的沉淀的质量等于加入的H2SO4溶液的质量,则硫酸溶液的浓度为_______mol/L。
下列化学反应对应的离子方程式书写正确的是
| A.FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-=Fe(SCN)3↓ |
| B.将少量二氧化硫通入次氯酸钠溶液中:SO2+H2O+ClO-=SO42-+Cl-+2H+ |
| C.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH-=NH3·H2O |
| D.用过量的氨水吸收烟道气中的SO2:SO2+2 NH3·H2O=2NH4++SO32-+H2O |
化学用语是化学学科的特色语言,化学用语可以准确表述化学现象、变化以及本质。完成下列有关方程式。
(1)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO ,常用作脱氯剂,该反应的离子方程式为_______________________;
,常用作脱氯剂,该反应的离子方程式为_______________________;
(2)酸性高锰酸钾溶液与过氧化氢溶液反应的离子方程式: ________________。
(3)化学反应多姿多彩,把SO2通入硝酸铁溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,此时向溶液中滴加氯化钡溶液,有白色沉淀产生。请写出上述变化中溶液由棕黄色变为浅绿色,但立即又变为棕黄色所涉及的两个离子方程式: ________________、_________________。
(4)向含有n mol 溴化亚铁的溶液中通入等物质的量的的氯气,请写出离子方程式: 。
下列离子方程式正确的是( )
| A.0.01mol/L NH4Al(SO4)2溶液与0.01mol/L Ba(OH)2溶液等体积混合 NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O |
| B.Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O |
| C.将11.2L标准状况下的氯气通入200mL2mol/L的FeBr2溶液中,离子反应方程式为: 4Fe2++6Br-+5Cl2= 4Fe3++3Br2+10Cl- |
| D.铁粉中滴加少量浓硝酸:Fe+3NO3-+6H+= Fe3++3NO2↑+3H2O |
Ⅰ.有一透明溶液,可能含有较大量的Mg2+、Fe3+、Al3+、Cu2+、Na+、H+、SO42-、CO32-中的一种或几种,取此溶液做下列实验
①取少量溶液加入用盐酸酸化的BaCl2溶液,有白色沉淀生成;
②取少量溶液加入过氧化钠粉末,溶液中有白色沉淀产生并逸出无色无味的气体,加入Na2O2的物质的量与析出沉淀的物质的量如图所示;
试推断:
(1)溶液中一定含有的离子是_________________;
(2)溶液中肯定不含有的离子是_________________;
(3)可能含有的离子是________________;
(4)为了进一步确定可能含有的离子,应增加的实验操作为___________________。
Ⅱ.某溶液中含有Ba2+、Cu2+、Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程如右图,已知沉淀2为蓝色。
(1)沉淀的化学式:沉淀1____________、沉淀3____________;
(2)写出混合液+A的离子方程式 _________________;
写出溶液+B生成沉淀2的离子方程式_________________;
下列指定反应的离子方程式不正确的是
| A.硫代硫酸钠溶液与稀硫酸混合:S2O32-+2H+=S↓+SO2↑+H2O |
| B.向CuSO4溶液中通入H2S气体:Cu2++S2-=CuS↓↑ |
| C.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色:2AgCl+S2-=Ag2S↓+2Cl- |
D.重铬酸钾的溶液中存在着如下平衡:Cr2O72-(橙红色)+H2O 2H++2CrO42-(黄色) 2H++2CrO42-(黄色) |
下列离子方程式正确的是( )
A.用铜为电极电解饱和食盐水:2Cl-+2H2O Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
B.浓硝酸溶液中加入过量铁粉并加热:Fe+3NO3-+6H+ Fe3++3NO2↑+3H2O Fe3++3NO2↑+3H2O |
| C.0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合: NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3•H2O |
| D.向小苏打溶液中加少量Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O |
下列解释事实的化学方程式或离子方程式不正确的是( )
| A.向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2=I2+2H2O |
| B.自然界各种原生铜的硫化物经氧化、淋滤作用后产生的硫酸铜,遇到难溶液的PbS,慢慢转变为铜蓝(CuS):Cu2++SO42-+PbS═CuS+PbSO4 |
| C.在燃煤时加入适量石灰石,可减少SO2的排放:2CaCO3+O2+2SO2═2CaSO3+2CO2 |
| D.在盐碱地(含较多NaCl、Na2CO3)上通过施加适量CaSO4,可降低土壤的碱性:CaSO4+Na2CO3═CaCO3↓+Na2SO4 |
Ⅰ有一份无色溶液,只可能有Na+、Cl-、H+、SO42-、CO32-、Cu2+、NO3-中的几种(忽略水电离产生的少量OH-)。取该溶液检测,发现溶液显强酸性。
(1)不需要进一步实验,可以判断,溶液中一定存在________,一定不存在__________。
(2)进一步测定,发现该溶液中c(H+)=0.1mol/L,取100mL该溶液,加入足量BaCl2,生成2.33g沉淀,过滤,滤液中加入足量AgNO3溶液,产生5.74g沉淀。100mL溶液中是否有Cl—______(填一定有、一定没有、可能有),100mL溶液中Na+的物质的量浓度至少为_______mol/L。
Ⅱ现有易溶于水的五种物质A、B、C、D、E,其中有一种是碱,四种是盐,溶于水后电离可以产生下表中的离子:
为鉴别它们,分别完成以下实验,其结果如下:
①A溶液与B溶液反应生成无色气体X,气体X可以和C溶液反应生成沉淀E,沉淀E可与B溶液反应;
②B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸.
请根据上述实验结果,填空:
(1)写出下列物质的化学式:X__________,C__________,B__________
(2)完成A溶液与X气体反应的离子方程式:__________
(3)D与E的混合物ag,加入足量盐酸,反应完毕生成标准状况时的气体bL,则D在混合物中的质量分数为_____________。
(4)已知NaHCO3溶液呈碱性,B溶液与A溶液反应至恰好溶液呈中性,写出该过程的离子方程式_________
粗盐中含有CaCl2、MgCl2、Na2SO4以及泥沙等杂质,请回答粗盐提纯的有关问题:
(1)NaCl既属于_______(填酸、碱或盐),也属于______(填强电解质或弱电解质),该分类方法称为_______,NaCl溶液中共含有________种微粒(包含分子和离子)
(2)为了除去可溶性杂质,可以按以下实验步骤进行提纯:①加过量BaCl2溶液;②加过量NaOH溶液;③加过量Na2CO3溶液;④过滤;⑤加适量盐酸.
其中,在步骤②中主要涉及的离子反应方程式是____________________________;步骤①和③能否交换顺序_______(填能或不能)。
(3)将ag粗盐样品溶于水,经过以上一系列提纯操作之后,实验完毕得到bg精盐(不考虑实验过程中操作引起的损耗),下列说法正确的是___________。(NA表示阿伏加德罗常数)
| A.粗盐中Na+数目为aNA/58.5 | B.精盐中NaCl物质的量为b/58.5mol |
| C.粗盐中NaCl的质量分数为b/a×100% | D.粗盐中关于NaCl的量无法确定 |
(4)某已滤去泥沙的粗盐经检验不含Na2SO4。该粗盐溶于水配成100mL溶液,加入过量稀NaOH溶液后,过滤得到沉淀Mg(OH)25.8g,滤液中通入CO2,得到如下图(横坐标表示通 入CO2标准状况下的体积,纵坐标表示沉淀的物质的量),回答下列问题:
①b段表示的离子方程式为__________
②100mL溶液中Ca2+的物质的量与所加NaOH的物质的量之比为__________
③P点表示的CO2的体积为__________(标准状况下)。
下列离子反应方程式正确的是
| A.在碳酸氢镁溶液中加入足量Ca(OH)2溶液: Mg2++HCO3-+Ca2++2OH–="=" MgCO3↓+CaCO3↓+2H2O |
| B.向饱和碳酸钠溶液通入过量的二氧化碳气体:CO32-+CO2+H2O=2HCO3- |
| C.将氯化亚铁溶液和稀硝酸混合:3Fe2++ 4H++NO3-= 3Fe3++2H2O+NO↑ |
| D.向明矾溶液中逐滴加入Ba(OH)2溶液至Al3+刚好沉淀完全: |
Al3+ +SO42—+Ba2+ +3OH—==BaSO4↓+Al(OH)3↓
离子方程式正确的是( )
| A.0.01mol NH4Al(SO4)2溶液与0.01mol·L-1Ba(OH)2溶液等体积混合 NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O |
B.用惰性电极电解CuCl2溶液:2Cu2++2H2O 2Cu+O2↑+4H+ 2Cu+O2↑+4H+ |
| C.将标准状况下的11.2L氯气通入200mL2mol·L-1的FeBr2溶液中,离子反应方程式为: 4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl- |
| D.铁粉中滴加少量浓硝酸:Fe+3NO3-+6H+=Fe3++3NO2↑+3H2O |
(1)二氧化硅与碳高温下反应的化学方程式为
上述反应中生成的单质有什么用途: (写一条即可)。卞石是硅酸盐,不同类型的卞石中氧原子的物质的量分数相同,由钠卞石化学式NaAlSi3O8可推知钙卞石的化学式为 ,请将钠卞石的化学式改写成氧化物的形式:
(2)天然气(主要成分甲烷)含有少量含硫化合物[硫化氢、羰基硫(COS)等],可以用氢氧化钠溶液洗涤除去.羰基硫用氢氧化钠溶液处理的过程如下(部分产物已略去):
COS Na2S溶液
Na2S溶液 H2 羰基硫分子的电子式为 。反应I除生成两种正盐外,还有水生成,其化学方程式为 。已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32﹣,则II中主要反应的离子方程式为 。
H2 羰基硫分子的电子式为 。反应I除生成两种正盐外,还有水生成,其化学方程式为 。已知反应II的产物X的溶液中硫元素的主要存在形式为S2O32﹣,则II中主要反应的离子方程式为 。