下列离子方程式不正确的是
| A.Fe3O4与稀硝酸反应的离子方程式为:Fe3O4 + 8H+===Fe2++2Fe3++4H2O |
| B.用稀硫酸除去铜绿:4H++Cu2(OH)2CO3==2Cu2++CO2↑+3H2O |
| C.向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42—完全沉淀:2Ba2++NH4++Al3++2SO42-+4OH-== Al(OH)3↓+NH3·H2O+2BaSO4↓ |
| D.少量氢氧化钙溶液与碳酸氢钠溶液混合:Ca2++2OH-+2HCO3—==CaCO3↓+2H2O+CO32— |
下列离子方程式书写正确的是
| A.稀硝酸溶液中加入氢氧化亚铁:Fe(OH)2+2H+=Fe2++2H2O |
| B.NaOH溶液中加入过量Ba(HCO3)2溶液:Ba2++2OH-+2HCO3-=BaCO3↓+2H2O+CO32- |
| C.FeI2溶液中通入极少量Cl2:2I-+Cl2=I2+2Cl- |
| D.AICl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O |
工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4·7H2O) ,流程如下:
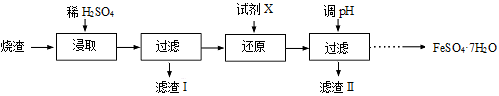
(1)浸取时,溶液中的Fe2+易被空气中的O2氧化,其离子方程式为 。能提高烧渣浸取速率的措施有 (填字母)。
A.将烧渣粉碎 B.降低硫酸的浓度 C.适当升高温度
(2)还原时,试剂X的用量与溶液pH的变化如图所示,则试剂X可能是 (填字母)。
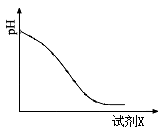
A.Fe粉 B.SO2 C.NaI
还原结束时,溶液中的主要阴离子有 。
(3)滤渣Ⅱ主要成分的化学式为 ;由分离出滤渣Ⅱ后的溶液得到产品,进行的操作是 、 过滤、洗涤、干燥。
下列指定反应的离子方程式正确的是
| A.氨水吸收少量的CO2气体:NH3·H2O+ CO2 = NH4++HCO3- |
| B.Na2SO3溶液中SO32-的水解:SO32-+ 2H2O=H2SO3+ 2OH- |
| C.KClO3溶液与浓盐酸反应: ClO3-+5Cl-+6H+=3Cl2↑+3H2O |
| D.(NH4)2Fe(SO4)2溶液与过量NaOH反应:Fe2++2OH-=Fe(OH)2↓ |
下列指定反应的离子方程式正确的是
| A.AlCl3溶液中加入过量稀氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O |
| B.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-=Fe(OH)2↓ |
| C.澄清石灰水中滴加少量NaHCO3: Ca2++ 2OH-+2HCO3-= CaCO3↓+2H2O+ CO32- |
| D.向Mg(HCO3)2溶液中加入过量的 NaOH溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O |
有一透明溶液,已知其中可能含有Fe3+、Mg2+、Cu2+、Al3+、NH4+,加入一种淡黄色粉末固体时,加热有刺激性气味的混合气体放出,同时生成白色沉淀。当加入0.4 mol淡黄色粉末时,产生气体0.3 mol,继续加入淡黄色粉末时,产生无刺激性气味的气体,且加入淡黄色粉末时产生白色沉淀的量如下图所示。(已知:NH4++OH- NH3↑+H2O)
NH3↑+H2O)
根据题意回答下列问题:
(1)淡黄色粉末为____________(填名称)。
(2)溶液中肯定有______________离子,肯定没有__________离子。
(3)溶液中离子的物质的量之比为______________________________。
(4)写出沉淀部分减少时的离子方程式:__________________________。
下列反应的离子方程式正确的是:
| A.过氧化钠固体与水反应制氧气:2O22-+2H2O=4OH-+O2↑ |
| B.在100mL浓度为1mol•L-1的Fe(NO3)3的溶液中通入足量SO2:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
| C.1 mol•L-1的NaAlO2溶液和2.5 mol•L-1的盐酸等体积混合:2AlO2-+5H+=Al(OH)3↓+Al3++H2O |
| D.向碳酸钠溶液中逐滴加入与之等体积等物质的量浓度的稀醋酸:CO32-+H+=HCO3- |
下列反应的离子方程式不正确的是
| A.向NaClO溶液中通入少量SO2气体:3ClO-+SO2+H2O═SO42-+Cl-+2HCl |
| B.将过量的Cl2通入FeBr2溶液中:2Fe2++2Br-+2Cl2=2Fe3++4Cl-+Br2 |
| C.向碳酸氢钙溶液中滴加氢氧化钠溶液至Ca2+恰好完全:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| D.向NH4Al(SO4)2溶液中滴加Ba(OH)2溶液至沉淀量最大: |
NH4++Al3++2SO42-+4OH-=Al(OH)3↓+2BaSO4↓+NH3·H2O
氧硫化碳(COS)可替代磷化氢而被用作蒸剂。
(1)组成氧硫化碳和磷化氢的各元素中,原子半径最大的元素是___________________(填元素符号)。
(2)下列事实可用于比较C与P两种元素非金属性相对强弱的是____________(填字母)。
a.最高正化合价:P>C
b.同温同浓度的两溶液的酸性:H3PO4>H2CO3
c.沸点:PH3>CH4
(3)氧硫化碳水解及部分应用流程如下(部分产物已略去):
①已知:常温下,反应Ⅱ中每吸收1.7g H2S气体,反应放出热量4.76kJ,则该反应的热化学方程式为____________________。
②已知M溶液中硫元素的主要存在形式为S2O32-,则反应Ⅲ中生成S2O32-的离子方程式为___________。
Ⅰ.过氧化氢俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。回答下列有关双氧水的问题:
(1)下述反应中,H2O2仅体现氧化性的反应是(填代号) 。
A.Na2O2+2HCl=2NaCl+H2O2
B.Ag2O+H2O2=2Ag+O2↑+H2O
C.2H2O2=2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8H2O
(2)保存过氧化氢的试剂瓶上最适合贴上的一个标签是 (填代号)。
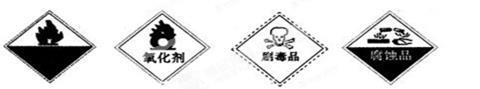
A.自燃物品 B.氧化剂 C.剧毒品 D.腐蚀品
Ⅱ某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,已知I2遇淀粉变蓝,设计实验如下:
实验①:在淀粉KI溶液中加入少量NaClO溶液,并加入少量的稀H2SO4,溶液立即变蓝;
实验②:向实验①的溶液中加入4 L 0.5 mol/L的Na2SO3溶液,发生反应如下
SO32-+ I2+H2O→SO42-+I-+H+(未配平),恰好完全反应。
(1)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是 。
(2)实验②中化学反应转移电子的物质的量是 。
(3)写出实验①中发生反应的离子方式 。
下列离子方程式正确的是
| A.电解氯化镁溶液:2Cl¯+ 2H2O ═ 2OH¯ + H2↑+ Cl2↑ |
| B.将少量SO2气体通入NaClO溶液中:SO2+H2O+2ClO-═SO32-+2HClO |
| C.将少量CO2气体通入苯酚钠溶液中:2C6H5O- + CO2 + H2O→2C6H5OH +CO32- |
| D.硫酸亚铁酸性溶液中加入过氧化氢:2Fe2+ + H2O2 +2H+ = 2Fe3+ + 2H2O |
下列有关NaHSO3溶液的叙述正确的是
| A.该溶液中,K+、Ca2+、Cl2、Br—可以大量共存 |
| B.能使含I2的淀粉溶液蓝色褪去,说明NaHSO3溶液具漂白性 |
| C.与FeCl3反应的离子方程式:SO32—+2Fe3++H2O = SO42—+2Fe2++ 2H+ |
| D.和足量Ca(OH)2溶液反应的离子方程式:Ca2++OH—+ HSO3—= CaSO3↓+H2O |
下列离子方程式书写正确的是
A.用Pt电极电解少量的MgCl2溶液:2H2O+2Cl- H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
| B.H218O中投入Na2O2固体:2H218O+2O22-=4OH-+18O2↑ |
| C.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-= CaCO3↓+H2O |
| D.FeSO4溶液中加H2O2溶液:Fe2++2H2O2+4H+= Fe3++4H2O |
下列离子方程式 错误的是
| A.向Ba(OH)2溶液中滴加稀硫酸: Ba2++2OH-+2H++SO42-= BaSO4↓+2H2O |
| B.酸性介质中KMnO4氧化H2O2: 2MnO4-+5H2O2+6H+=2Mn2++5O2↑+8H2O |
| C.0.01 mol·L-1 NH4Al(SO4)2溶液与0.02 mol·L-1 Ba(OH)2溶液等体积混合: NH4++Al3++SO42-+Ba2++4OH-= BaSO4↓+Al (OH)3↓+NH3·H2O |
| D.铅蓄电池充电时的正极反应:PbSO4+2H2O-2e-=PbO2+4H++SO42- |