下列离子组中所给离子在水溶液中能大量共存,且当加入试剂后反应的离子方程式书写完全且正确的是
| 选项 |
离子组 |
加入试剂 |
发生反应的离子方程式 |
| A |
Fe3+、S2ˉ、Clˉ、Na+ |
NaOH溶液 |
Fe3++3OHˉ=Fe(OH)3↓ |
| B |
Na+、Al3+、Clˉ、SO42ˉ |
少量KOH溶液 |
Al3++3OHˉ=Al(OH)3↓ |
| C |
H+、Fe2+、SO42ˉ、NO3ˉ |
BaCl 2溶液 |
SO42ˉ+Ba2+=BaSO4↓ |
| D |
Na+、K+、ClOˉ、SO42ˉ |
通入少量SO2 |
2ClOˉ+SO2+H2O=2HClO+SO32ˉ |
Ⅰ.现有Al3+、NH4+、CO32—、HCO3— 等离子,回答下例问题:
①在强酸性条件下能够存在的离子是 ;
②在强碱性条件下能够存在的离子是 ;
③在强酸性和强碱性条件下都不能存在的离子是 。
Ⅱ.由Na+、NH4+、 Ba2+、 Cu2+、 OH—、 Fe3+、 SO42—、 Cl— 等八种离子中的六种两两组成的A、B、C三种化合物(它们不含有共同离子,已知NH4+与OH— 反应有碱性气体生成)。
A.A、B、C均易溶于水,形成无色溶液;
B.将A、B、C三种物质的溶液相互作用时,发现A与B混合后产生有刺激性气味的气体,此气体使湿润红色石蕊试纸变蓝,B与C混合产生白色沉淀,则:
①A、B、C的化学式为:
A、 ;
B、 ;
C、 。
②B+C反应的离子方程式为: 。
能正确表示下列反应的离子方程式是
| A.Fe(N03)3溶液中加入过量HI溶液:2Fe3++2I-=2Fe2++I2 |
| B.浓烧碱溶液中加入铝片:2A1+20H-=2AlO2-+H2 |
| C.H2SO4与Ba(OH)2溶液反应:Ba2+OH-+H++SO42-=BaSO4+H2O |
| D.将新制氢氧化铜悬浊液加入氨水中:Cu(OH)2+4NH3=[Cu(NH3)4]2+++2OH- |
能正确表示下列反应的离子方程式是( )
| A.向硫酸铜溶液中加入过量的NaHS溶液:Cu2++2HS-=CuS↓+H2S↑ |
| B.NH4Al(SO4)2溶液与足量的Ba(OH)2溶液混合: NH4++Al3++ 2SO42-+ 2Ba2++ 4OH-=2BaSO4↓ + Al(OH)3↓ + NH3·H2O |
| C.向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+ |
| D.铅酸蓄电池充电时的负极反应:PbSO4+2H2O-2e-=PbO2+4H++SO42— |
下列离子方程式书写不正确的是( )
| A.AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时,2Al3+ + 7OH-=Al(OH)3↓+ AlO2- + 2H2O |
| B.CuCl2溶液与NaHS溶液反应,当n(CuCl2):n(NaHS)=1:2时Cu2++2HS-=CuS↓+H2S↑ |
| C.Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2+ + 4Br- +3Cl2=2 Fe3+ + 2Br2 + 6Cl- |
| D.Fe与稀硝酸反应,当n(Fe):n(HNO3)=1:2时,3 Fe +2NO3- +8H+=3Fe2+ +2NO↑+4H2O |
下列离子方程式正确的是( )
| A.0.01mol/L NH4Al(SO4)2溶液与0.02mol/L Ba(OH)2溶液等体积混合 NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3·H2O |
| B.FeCl2酸性溶液放在空气中变质:2Fe2++4H++O2===2Fe3++2H2O |
| C.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ |
D.电解MgCl2水溶液的离子方程式:2Cl-+2H2O H2↑+Cl2↑+2OH- H2↑+Cl2↑+2OH- |
下列离子方程式书写正确的是
| A.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| B.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3-+Ca2++OH-=CaCO3↓+H2O |
C.以石墨作电极电解氯化铝溶液:2Cl-+2H2O 2OH-+H2↑+Cl2↑ 2OH-+H2↑+Cl2↑ |
| D.FeBr2与等物质的量的Cl2反应:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 |
短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液吸收得到无色溶液F。溶液F空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。
(1)单质A是一种黄色固体,组成单质A的元素在周期表中的位置是________________。用物理方法洗去试管内壁的A,应选择的试剂是_______________;化学方法洗去试管内壁的A是发生歧化反应生成两种盐,但这两种盐在强酸性条件下不能大量共存,请写出化学方法洗去试管内壁的A时发生的化学反应方程式______________________________。
(2)工业上获得B时常使用电解法,请写出阳极反应的电极反应_________________。
(3)FeCl3溶液中的Fe3+可以催化G与氧气在溶液中的反应,此催化过程分两步进行,请写出Fe3+参与的第一步反应的离子反应方程式_____________________________。
(4)工业上吸收E常用氨水,先生成正盐最终产物为酸式盐。E与该正盐反应的化学方程式___________________________.
(5)将D溶于稀硫酸,向恰好完全反应后所得的溶液中加入过量氢氧化钡溶液,则加入氢氧化钡溶液的过程中的现象是_____________________________。
(6)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯。该反应的氧化产物为__________,当生成2mol二氧化氯时,转移电子___________mol。
(7)H的溶液与稀硫酸反应的化学方程式______________________________。
下列离子方程式书写正确的是
| A.氯化钙溶液中通入CO2气体:Ca2++CO2+H2O=CaCO3↓+2H+ |
B.以石墨作电极电解氯化铝溶液:2Cl-+ 2H2O 2OH-+ H2↑+ Cl2↑ 2OH-+ H2↑+ Cl2↑ |
| C.Ca(C1O)2溶液中通人过量的SO2气体:ClO-+SO2+H2O=HSO3-+HClO |
| D.向明矾溶液中加入氢氧化钡溶液至沉淀的质量最大:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O |
已知部分弱酸的电离平衡常数如下表:
下列离子方程式正确的是
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-=CO +2HClO +2HClO |
| B.少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO |
C.少量的SO2通入Na2CO3溶液中:SO2+H2O+2 CO =SO =SO +2HCO3- +2HCO3- |
| D.相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-=CO2↑+H2O |
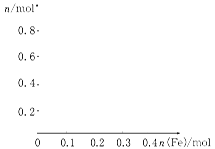
向含有0.8 mol的稀硝酸中慢慢加入22.4 g的铁粉,假设反应分为两个阶段。
第一阶段为:Fe+HNO3(稀)→Fe(NO3)3+NO↑+H2O
(1)写出这两个阶段发生反应的离子方程式:
第一阶段: 。
第二阶段: 。
(2)在图中画出溶液中Fe2+、Fe3+、NO3-的物质的量随加入铁粉的物质的量变化的关系图象(横坐标为加入铁粉的物质的量,纵坐标是溶液中离子的物质的量)。
Ⅰ、以下是依据一定的分类标准,对某些物质与水的反应情况进行分类的分类图。请根据你所学的知识按要求填空:

(1)上述第一级分类标准(分成A、B组的依据)是:__________________
(2)D组物质包括_________________________________(填化学式)。
(3)C组物质中某一物质在常温时能与冷水反应,其化学方程式为_____ ____。
(4)D组中某一物质与E组中某一物质在水中反应生成两种强酸,写出该反应的离子方程式:_______________________________________________________。
Ⅱ、下图中每一方格表示有关的一种反应物或生成物。A、C为无色气体。

(1)物质M可以是________或________,C是________,F是________。
(2)反应①的化学方程式______________________________。
(3)反应②的离子方程式_______________________________。
(4)F→G的化学方程式_________________________________。
将镁、铝的混合物共0.2 mol,溶于200mL 4mol/L的盐酸溶液中,然后再滴加2 mol/L 的NaOH溶液。请回答下列问题:

(1)若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V变化情况如图所示。当V1=160mL时,则金属粉末中n(Al)= mol;
(2)0~V1段发生的反应的离子方程式为 ;
(3)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积
V(NaOH)= mL。
(4)若镁、铝的混合物仍为0.2 mol,其中镁粉的物质的量分数为a,改用200 mL 4mol/L的硫酸溶解此混合物后,再加入840mL 2mol/L的NaOH溶液,所得沉淀中无Al(OH)3。则a的取值范围为 。
下列事实、离子方程式及其对应关系均正确的是
A.向Ag2S 浊液中滴加少量稀NaCl 溶液,黑色沉淀逐渐变成白色: Ag2S +Cl- AgCl +S2- AgCl +S2- |
| B.向K2Cr2O7 溶液中滴加少量浓H2SO4,溶液变为黄色: Cr2O72-(橙色) + H2O  2CrO42-(黄色) +2H+ 2CrO42-(黄色) +2H+ |
| C.向淀粉碘化钾溶液中滴加稀硫酸,在空气中放置一段时间后溶液变蓝: 4H+ + 4I- + O2= 2I2 + 2H2O |
D.向水杨酸(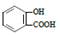 )中滴加NaHCO3溶液,放出无色气体: )中滴加NaHCO3溶液,放出无色气体: |
I.(1)鉴别KCl溶液和K2CO3的试剂是 ,除去SO2中的HCl的试剂是 。
(2)除去Na2CO3粉末中混入的NaHCO3杂质用 方法。分离碘和CCl4的操作方法 。
(3)除去混入Fe2O3中少量SiO2杂质的试剂是 ,离子方程式为 。
II.氧化还原反应在工农业生产和日常生活中有广泛的应用,回答下列问题:
(4)罐头厂在装食品罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质,此类食物防腐剂应具有________。(填“氧化性”或“还原性”)
(5)铁是生物体中不可缺少的微量元素,铁在人体中是以Fe2+和Fe3+的形式存在的,而Fe2+更容易被吸收,服用维生素C可使食物中的Fe3+转化为Fe2+,在这个过程中维生素C所起的作用是 。(填“氧化剂”或“还原剂”)
(6)氯气是一种重要的工业原料且HCl遇NH3会产生NH4Cl,NH4Cl为白色固体。工业上利用反应:3Cl2+2NH3===N2+6HCl检查氯气管道是否漏气。下列说法错误的是________。
| A.若管道漏气遇NH3就会产生白烟 | B.该反应利用了Cl2的强氧化性 |
| C.该反应属于复分解反应 | D.生成1 mol N2有6 mol电子转移 |