下列离子方程式错误的是
| A.向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2H++ SO42-=BaS04↓+2H2O |
| B.酸性介质中KMnO4氧化H2O2:2MnO4- +5H2O2+6H+=2Mn2++5O2↑+ 8H2O |
| C.等物质的量的MgCl2、Ba(OH)2和HC1 溶液混合:Mg2++2OH-=Mg(OH)2↓ |
| D.铁铜原电池(稀硫酸做电解质)放电时的负极反应:Fe-2e-=Fe2+ |
某工业废水中含有大量的FeSO4、较多的Cu2+和少量的Fe3+。为了较少污染并变废为宝,拟从该废水中回收硫酸亚铁和金属铜,其流程如下图。请完成下列问题。
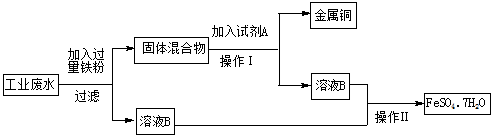
(1)检验工业废水中含有Fe3+的方法是 。
(2)工业废水中加入过量铁粉时,有Fe3+参加的离子反应方程式为 。
(3)操作Ⅰ为 。
下列实验现象及相关的离子方程式均正确的是
| A.Cl2与FeI2溶液反应,当n(C12):n(FeI2)=1:1时,2Fe2++2I-+2C12=2Fe3++I2 +4C1- |
| B.向Ba(NO3)2溶液中通人SO2气体,出现白色沉淀:Ba2++SO2+H2O=BaSO3↓+2H+ |
| C.向H2O2溶液中滴加酸化的KMnO4溶液,KMnO4溶液褪色:2MnO4-+7 H2O2+6H+=2Mn2++6O2↑+10 H2O |
D.将等物质的量浓度、等体积的Ba(OH)2溶液和NaHSO4溶液混合:Ba2++SO +H++OH-=aSO4↓+H2O +H++OH-=aSO4↓+H2O |
常温下,将0.01 mol CH3COONa 和0.002 molHCl溶于水,形成1L混合溶液:
(1)该溶液中存在三个平衡体系,用电离方程式或离子方程式表示①和②:
① 。
② 。
③CH3COOH CHCOO-+H+。
CHCOO-+H+。
(2)溶液中共有 种不同的粒子(指分子和离子),在这些粒子中,浓度为0.01 mol/L的是 ,浓度为0.002 mol/L的是 。
(3)在上述溶液中,存在的两个守恒关系是:
①物料守恒,C(CH3COO-)+C(CH3COOH)= mol/L;
②电荷守恒,即: 。
下列反应的离子方程式正确的是
A 硫酸铜溶液与氢氧化钡溶液反应: Ba2++SO42-=BaSO4↓
B 向三氯化铝溶液中加入过量氨水:Al3++3NH3·H2O=A1(OH)3↓+3NH4+
C 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH—=CaCO3↓+H2O
D 石灰石溶于醋酸: CaCO3+2H+=Ca2++CO2↑+H2O
能正确表示下列反应的离子方程式是
| A.向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O |
B.实验室制氨气:NH4++OH- NH3↑+H2O NH3↑+H2O |
C.碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH- NH3↑+H2O NH3↑+H2O |
| D.AlCl3溶液中滴加足量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O |
若四种溶液,分别含有: ①Al3+ ②Mg2+ ③Fe2+ ④Fe3+ 离子。请回答下列问题:
(1)遇KSCN溶液呈红色的是 。
(2)加铁粉溶液质量增重的是 。
(3)加入过量NaOH溶液中最终无沉淀的是 。
(4)加入新制Cl2水溶液变黄色的是 ,反应的离子方程式是 。
下列框图所示的转化关系中,甲为生活中常见的金属单质,乙、丙、丁为气体单质,D为家庭中常用物质(部分反应物和生成物及溶剂水已略去).
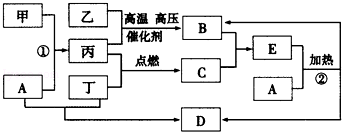
请回答:
(1)E的化学式为 ;甲的原子结构示意图为 ;
(2)反应①的离子方程式为 ;反应②的化学方程式为 ;
(3)实验室制取并收集B的操作中,用 法收集B,验证B已收集满的方法是 (限答一种).
(4)实验室制备丁的方程式为 ,工业上输送丁的管道出现气体泄漏,如何查漏(用方程式表示) .
下列离子方程式中,正确的是
| A.NaAlO2溶液中通入少量二氧化碳:AlO2-+CO2+2H2O =Al(OH) 3↓+HCO3- |
| B.高锰酸钾酸性溶液与草酸溶液反应: 2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+ 8H2O |
| C.用稀硫酸除去铁片表面的铁锈:FeO+2H+ =Fe2++H2O |
D.用惰性电极电解饱和食盐水:2C1-+2H2O  Cl2↑+H2↑+2OH- Cl2↑+H2↑+2OH- |
下列离子方程式的书写正确的是( )
| A.实验室用大理石和稀盐酸制取CO2:2H++CO32-=CO2↑+H2O |
| B.向氯化亚铁溶液滴加新制氯水:2Fe2++Cl2=2Fe3++2Cl- |
| C.向AlCl3溶液中加入过量的NaOH溶液:Al3++3OH-=Al(OH)3↓ |
| D.铁和稀盐酸反应:2Fe+6H+=3H2↑+2Fe3+ |
已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:
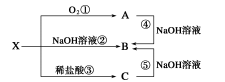
(1)写出下列物质的化学式:X ,A ,B C ;
(2)写出以下反应的离子方程式:
②
④
在如图所示的一些常见单质,化合物等物质之间的转化关系中(有些反应过程中的水,部分产物和反应条件未全部列出),已知反应①是氯碱工业的最基础的反应,A、B、F、H、J的焰色反应均为黄色,热的F溶液可以去除物品表面的油污,I为地壳中含量最多的金属元素的单质,L是典型的两性氧化物,在常温常压下C、D、G均为气体,D呈黄绿色,G是形成温室效应的主要气体.
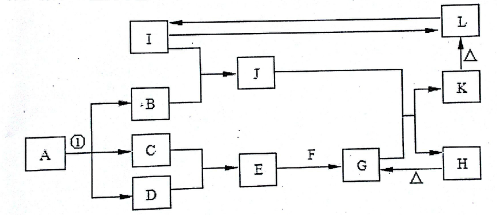
(1)反应①进行的条件为 .
(2)化合物F的化学式为 .
(3)I与氧化铁反应的化学方程式为 .
(4)J的水溶液与G反应生成K和H的离子方程式为 .
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是 (用离子方程式表示),FeCl3净水的原理是 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+) = 1.0 × 10-3 mol·L-1 , c(Cl-) = 5.3 × 10-2 mol·L-1,则该溶液的pH约为 。
②完成NaClO3氧化FeCl2的离子方程式:  Fe2++
Fe2++ ClO3-+
ClO3-+  =
=  Fe3++
Fe3++ Cl-+
Cl-+ 。
。
(3)FeCl3在溶液中分三步水解:
Fe3++H2O 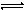 Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O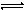 Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O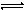 Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O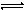 Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是 (填序号)。
| A.加水稀释 | B.降温 | C.加入NH4HCO3 | D.加入NH4Cl |
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是 。
盛放NaOH溶液的试剂瓶不能用玻璃塞,是为了防止发生反应(用离子方程式表示)________,避免瓶口与瓶塞粘在一起。
钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示:
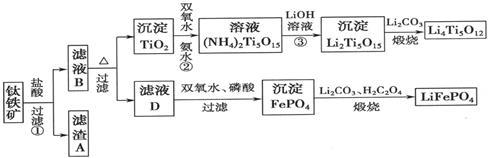
已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl—= Fe2++ TiOCl42—+2H2O
(1)化合物FeTiO3中铁元素的化合价是___________。
(2)滤渣A的成分是___________。
(3)滤液B中TiOCl42-和水反应转化生成TiO2的离子方程式是 。
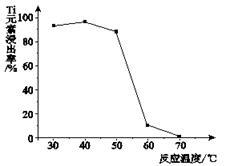
(4)反应②中固体TiO2转化成(NH4)2Ti5O15 溶液时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti元素浸出率下降的原因 。
(5)反应③的化学方程式是 。
(6)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是___________。
(7)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)作电极组成电池,其工作原理为:Li4Ti5O12 + 3LiFePO4 Li7Ti5O12 + 3FePO4 该电池充电时阳极反应式是: 。
Li7Ti5O12 + 3FePO4 该电池充电时阳极反应式是: 。