下列离子方程式正确的是
| A.以石墨作电极电解CuCl2溶液:2Cl-+2H2O=2OH-+Cl2↑十H2↑ |
| B.双氧水加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O |
| C.Na2O2溶于水产生O2:Na2O2+H2O=2Na++2OH-+O2↑ |
| D.Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O |
某科研小组探究工业废Cu粉(杂质含有SiO2、Al2O3、Fe2O3中的一种或几种)的组成并制备少量CuSO4·5H2O,实现废物综合利用,实验过程如下:
过程Ⅰ:

(1)废Cu粉中一定含有的杂质是 (填化学式)
(2)写出过程②发生反应的离子方程式: 。
过程Ⅱ:

(3)综合过程Ⅰ、II,计算废Cu粉中各成分的质量之比是 (化为最简整数比)
过程Ⅲ:已知25℃时:
| 电解质 |
Cu(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
| 溶度积(Ksp) |
2.2×10-20 |
8.0×10-16 |
4.0×10-38 |
| 开始沉淀时的pH |
5.4 |
6.5 |
3.5 |
| 完全沉淀时的pH |
6.4 |
9.6 |
4.0 |
(4)在Ⅱ中所得蓝色溶液中加入一定量的H2O2溶液,调节溶液的pH范围为 ,然后过滤、结晶,可得CuSO4·5H2O。
(5)下列与 Ⅲ方案 相关的叙述中,正确的是 (填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质、不产生污染
B.将Fe2+ 氧化为Fe3+ 的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH选择的试剂可以是氢氧化铜或氧化铜
D.在pH>4的溶液中Fe3+一定不能大量存在
下列反应的离子方程式正确的是
A 硫酸铜溶液与氢氧化钡溶液反应: Ba2++SO42-=BaSO4↓
B 向三氯化铝溶液中加入过量氨水:Al3++3NH3·H2O=A1(OH)3↓+3NH4+
C 向碳酸氢钙溶液中加入过量氢氧化钠溶液:Ca2++HCO3-+OH—=CaCO3↓+H2O
D 石灰石溶于醋酸: CaCO3+2H+=Ca2++CO2↑+H2O
铁是人体不可缺少的微量元素,摄入含铁的化合物可补充铁。“速力菲”是市场上一种常见的补铁药物,右图是它的说明书: 
该药品中Fe2+会缓慢氧化,国家规定该药物中Fe2+的氧化率超过10%即不能再服用.
(1)为了检验某药店出售的“速力菲”是否被氧化,实验室可选用的最常用最灵敏的检验试剂为_______(填试剂的名称)。
(2)实验室采用H2SO4酸化的KMnO4溶液对“速力菲”中的Fe2+进行滴定(假设药品中其他成分不与KMnO4反应);该反应的离子方程式为:_____________________________。
(3)称量上述含铁元素质量分数为20.00%的“速力菲”20.00g,将其全部溶于稀硫酸中,配制成1 000.00mL溶液.取出20.00mL,用0.01mol/L的KMnO4溶液滴定,消耗KMnO4溶液体积如下图所示。
①仪器A的名称是________:由上图可知消耗KMnO4溶液体积为_________ mL;
②滴定终点观察到的现象为______________________________;
③以标准KMnO4溶液滴定样品溶液的浓度,判断以下操作所引起实验结果偏小的是________。
| A.滴定过程中,锥形瓶振荡太剧烈,有少量液滴溅出 |
| B.滴定前俯视,滴定后仰视(标准液) |
| C.滴定接近终点时,用少量蒸馏水冲洗瓶内壁 |
| D.未用标准KMnO4溶液润洗滴定管 |
④该药品可以服用吗?_____(填“可以”或“不可以”)
A、B、C、D均为中学化学常见的纯净物,A是单质。它们之间有如下的反应关系:
(1)若B是淡黄色固体,②③反应均用到同一种液态氢化物。D物质常用于食品工业。写出④反应的化学方程式 ;
(2)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染。写出③反应的化学方程式 ;
(3)若D物质具有两性,②③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体。写出④反应离子方程式 ;
(4)若A是太阳能电池用的光伏材料。C、D为钠盐,两种物质中除钠、氧外的元素为同一主族,且溶液均显碱性。写出②反应的化学方程式 ;
(5)若A是应用最广泛的金属。④反应用到A,②⑤反应均用到同一种非金属单质。写出④反应的离子方程式 。
(根据下列框图关系填空,已知反应①、③是我国工业生产中的重要反应,X常温下为无色无味透明液体;C焰色反应火焰呈黄色,J为红褐色沉淀;D、E常温下为气体,且E能使品红溶液褪色;A固体中仅含两种元素,其中金属元素的质量分数约为46.7%。
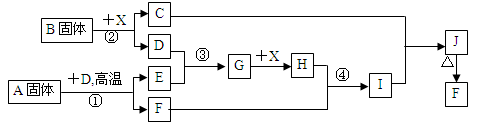
(1)A的化学式为 ; F的化学式为 ;
(2)反应 ③的化学方程式: ;
(3)反应②的离子方程式: ;
(4)反应④的离子方程式: ;
(5)已知每生成16 g E,放出106.5 kJ热量,则反应①的热化学方程式为:
。
能正确表示下列反应的离子方程式是
| A.向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O |
B.实验室制氨气:NH4++OH-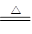 NH3↑+H2O NH3↑+H2O |
C.碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH4++OH-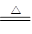 NH3↑+H2O NH3↑+H2O |
| D.AlCl3溶液中滴加足量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O |
某氯化铁与氯化亚铁的混合物。现要测定其中铁元素的质量分数,实验按以下

步骤进行:
Ⅰ.请根据上面流程,回答以下问题:
(1)操作Ⅰ所用的玻璃仪器除烧杯、玻璃棒外,还必须有 、 ,(填仪器名称)。
(2)请写出加入溴水发生的离子反应方程式 。
(3)将沉淀物加热,冷却至室温,用天平称量其质量为b1g,再次加热并冷却至室温称量其质量为b2g,若b1-b2=0.3g,则接下来还应进行的操作是 ;若蒸发皿质量是W1g,蒸发皿与加热后固体总质量是W2g,则样品中铁元素的质量分数是 。
Ⅱ.有同学提出,还可以采用以下方法来测定:

(1)溶解样品改用了硫酸,而不再用盐酸,为什么?
(2)选择的还原剂时否能用铁 (填“是”或“否”),原因是: 。
(3)若滴定用掉cmol/L高锰酸钾溶液bmL,则样品中铁元素的质量分数是 。
电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。用FeCl3溶液做腐蚀液与Cu反应生成CuCl2和FeCl2。
(1)写出该反应的化学方程式 。
(2)印刷电路的废腐蚀液含有大量CuCl2、FeCl2、FeCl3,任意排放会造成环境污染及资源的浪费。通过下列流程可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。

学科Ⅰ、步骤②需加入的试剂A是 (填化学式);
Ⅱ、步骤③通入的气体B是 (填化学式),写出该反应的离子方程式: 。
已知X是某金属单质,X、A、B、C含同一种元素,可发生如下转化:
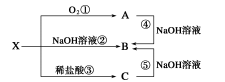
(1)写出下列物质的化学式:X ,A ,B C ;
(2)写出以下反应的离子方程式:
②
④
在如图所示的一些常见单质,化合物等物质之间的转化关系中(有些反应过程中的水,部分产物和反应条件未全部列出),已知反应①是氯碱工业的最基础的反应,A、B、F、H、J的焰色反应均为黄色,热的F溶液可以去除物品表面的油污,I为地壳中含量最多的金属元素的单质,L是典型的两性氧化物,在常温常压下C、D、G均为气体,D呈黄绿色,G是形成温室效应的主要气体.
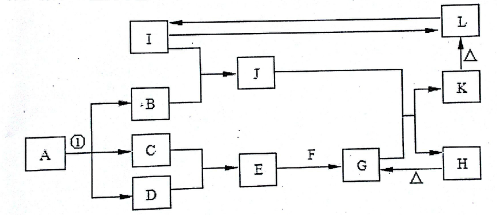
(1)反应①进行的条件为 .
(2)化合物F的化学式为 .
(3)I与氧化铁反应的化学方程式为 .
(4)J的水溶液与G反应生成K和H的离子方程式为 .
FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:
(1)FeCl3溶液腐蚀钢铁设备,除H+作用外,另一主要原因是 (用离子方程式表示),FeCl3净水的原理是 。
(2)为节约成本,工业上用NaClO3氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+) = 1.0 × 10-3 mol·L-1 , c(Cl-) = 5.3 × 10-2 mol·L-1,则该溶液的pH约为 。
②完成NaClO3氧化FeCl2的离子方程式:  Fe2++
Fe2++ ClO3-+
ClO3-+  =
=  Fe3++
Fe3++ Cl-+
Cl-+ 。
。
(3)FeCl3在溶液中分三步水解:
Fe3++H2O  Fe(OH)2++H+ K1
Fe(OH)2++H+ K1
Fe(OH)2++H2O Fe(OH)2++H+ K2
Fe(OH)2++H+ K2
Fe(OH)++H2O Fe(OH)3+H+ K3
Fe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+
Fex(OH)y(3x-y)++yH+
欲使平衡正向移动可采用的方法是 (填序号)。
| A.加水稀释 | B.降温 | C.加入NH4HCO3 | D.加入NH4Cl |
室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是 。
盛放NaOH溶液的试剂瓶不能用玻璃塞,是为了防止发生反应(用离子方程式表示)________,避免瓶口与瓶塞粘在一起。
硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
| 物质 |
熔点/℃ |
沸点/℃ |
其它性质 |
| SO2Cl2 |
-54.1 |
69.1 |
①易水解,产生大量白雾 ②易分解:SO2Cl2  SO2↑+Cl2↑ SO2↑+Cl2↑ |
| H2SO4 |
10.4 |
338 |
吸水性且不易分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:

(1)仪器A冷却水的进口为 (填“a”或“b”)。
(2)仪器B中盛放的药品是 。
(3)实验时,装置丁中发生反应的离子方程式为 。
(4)装置丙的作用为 ,若缺少装置乙,则硫酰氯会水解,该反应的化学方程式为 。
(5)少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H=H2SO4 + SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的方法是 。
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液): 。