W、X、Y、Z均为短周期主族元素。Y的原子序数是W和Z的原子序数之和的一半,且其原子的最外层电子数与核外电子总数之比为2:7,W和Z形成的可溶性化合物WZ溶于水不能促进水的电离,W、X、Z三种元素形成的某种常见化合物M能消毒,下列说法正确的是
| A.Y与Z形成的化合物中含有离子键 |
| B.W、X、Z的简单离子中半径最大的是W |
| C.M的水溶液呈碱性 |
| D.1molW单质与足量X单质反应,转移电子物质的量可能是2mol,也可能是1mol |
铝、破(Be)在元素周期表中的位置是对角线关系,具有相似的化学性质,下列说法正确的是
| A.BeCl2水溶液导电性很强,故BeCl2是离子化合物 |
| B.Na2BeO2溶液PH>7,将其蒸干灼烧后得到固体BeO |
| C.向Na2BeO2溶液中加入过量盐酸制备Be(OH)2 |
| D.Be(OH)2与NaOH反应的离子方程式为:Be(OH)2+2OH-=BeO22-+2H2O |
如果将前18号元素按原子序数递增的顺序排列,可形成如图所示的“蜗牛”形状。图中每个“·”代表一种元素,其中①代表氢元素。下列说法不正确的是
| A.①~⑦所代表的元素中,共有2种金属元素,5种非金属元素 |
| B.③④⑤代表的元素所形成的化合物中,某些化合物可使酸性高锰酸钾溶液褪色 |
| C.①~⑦所代表的元素中,元素④所形成的简单离子半径最大 |
| D.气态氢化物的沸点及稳定性元素④比⑦好 |
下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质),其中曲线走势与元素有关性质相符的是
| A.①表示ⅥA族元素的氢化物的沸点 |
| B.②表示ⅦA族元素的熔点 |
| C.③表示Na+、Mg2+、Al3+的半径 |
| D.④表示第三周期元素的单质的熔点 |
a.b.c.d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。下列叙述错误的是
| A.四种元素中d元素的非金属性最强 |
| B.它们均存在两种或两种以上的氧化物 |
| C.只有a与其他元素生成的化合物都是离子化合物 |
| D.b.c.d与氢形成的化合物中化学键均为极性共价键 |
下列关于碱金属某些性质的排列中,正确的是
| A.原子半径:Li<Na<K<Rb<Cs |
| B.密度:Li<Na<K<Rb<Cs |
| C.熔点、沸点:Li<Na<K<Rb<Cs |
| D.还原性:Li>Na>K>Rb>Cs |
五种短周期元素A、B、C、D、E,原子序数逐渐增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子数多3个。E周期序数等于E原子最外层电子数。根据以上信息回答下列问题:
(1)A、B、C、D、E五种元素的原子半径由小到大的顺序是 (用元素符号填写)
(2)乙物质中存在的化学键类型是 。
(3)选用恰当的试剂除去D中少量的E,写出发生反应的化学方程式
(4)化合物乙的电子式
(5)将D、E的单质插入NaOH溶液中,构成原电池,其负极反应是
原子序数依次递增的 4 种短周期元素可形成简单离子,W2-、X+、Y3+、Z2-,下列说法不正确的是
| A.工业上常采用电解法冶炼Y 单质 |
| B.气态氢化物的稳定性: H2W强于H2Z |
| C.离子半径由大到小:、Z2->X+>Y3+>W2- |
| D.W、X 形成的化合物中阴、阳离子个数比一定是1:2 |
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同。
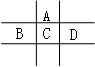
回答下列问题:
(1)A与E形成的化合物的化学式是 。
(2)B的最高价氧化物化学式为 ,C的元素名称为 ,
D的单质与水反应的方程式为_ 。
(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是 ,有关反应的离子方程式为 ; 。
下列说法正确的是
A. 医疗上使用的131I和127I互为同位素
B. C、N、O的最高正价依次升高,对应气态氢化物稳定性依次增强
C.  、
、 、
、 三种离子具有相同的电子层结构,则原子序数c>a>b
三种离子具有相同的电子层结构,则原子序数c>a>b
D. P、S、Cl原子半径依次减小,对应含氧酸的酸性依次增强
七种短周期元素在元素周期表中的相对位置如表所示。其中B的最高价氧化物的水化物能与B的气态氢化物反应生成离子化合物,下列说法正确的是
A.氧化物对应的水化物的酸性:G一定强于F
B.简单离子的半径:F>G>C>D
C.1 mol EC2中含2 mol E-C键
D.A、G分别与氢元素形成的化合物中,化学键均为极性共价键
五种不同元素X、Y、Z、D、E、F的信息如下:
| 元素 |
有关信息 |
| X |
元素主要常见化合价为-2和-1价,原子半径为0.074 nm。 |
| Y |
所在主族序数与所在周期序数之差为4。 |
| Z |
原子半径为0.102 nm,核外最外层电子数是其电子层数的2倍,其气态氢化物与Y单质发生反应生成淡黄色固体。 |
| D |
最高价氧化物对应的水化物,能电离出离子数、电子数都相等的阴、阳离子。 |
| E |
单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏。 |
| F |
元素所在的主族序数等于周期序数。 |
请回答下列问题:
(1)Z在周期表中的位置_________,D的最高价氧化物对应水化物的电子式为__________
(2)X单质与D单质反应生成的D2X2能和H2O反应,写出其离子方程式为 。
(3)E元素与Y元素可形成EY2和EY3两种化合物,向淀粉碘化钾溶液滴加几滴EY3的浓溶液,原无色溶液可变为紫色,其原因是 (用离子方程式表示)。
(4)E单质在发生吸氧腐蚀时的正极反应方程式
(5)F的一种复盐常用作净水剂,用离子方程式表示其净水原理
X、Y、Z、W是原子序数依次增大的四种短周期主族元素,已知Z的最高正价与最低负价的代数和为4,Y能形成两种常见的液体二元化合物M、Q,其中M是生物生存必需的物质.x能形成多种单质,其中有两种单质硬度差异极大,下列说法中错误的是:
| A.最高价氧化物对应水化物的酸性:W>Z>X |
| B.化合物Q有强氧化性 |
| C.Z、X都可以形成两种常见的酸性氧化物 |
| D.四种元素的常见单质中X的单质的沸点最高 |
A、B、C、D、E、F六种短周期主族元素,原子序数依次增大,A、B、F三者原子序数之和为25,且知B、F同主族,1.8g E与足量的盐酸反应生成ECl3和2.24L氢气(标准状况下),D+和E的离子具有相同的电子层结构,工业上用电解元素B和E能形成离子化合物的方法冶炼E单质,试判断:
(1)六种元素中非金属性最强的是 (填代号),该元素位于周期表中第 周期第 族;
由A、B、D三种元素形成化合物的电子式
(2)下列能够说明B、F非金属性强弱的方法有
a.最高价氧化物对应水化物酸性
b.气态氢化物的热稳定性
c.气态氢化物的沸点B比F高
d.向F的气态氢化物溶液中通入B单质,有浑浊
(3)写出下列反应的化学方程式
①E与足量的盐酸反应的化学方程式
②写出足量D的最高价氧化物对应水化物与ECl3相互反应的离子方程式