(12分)工业上以碳酸锰矿为主要原料生产MnO2的工艺流程如下:

有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Pb(OH)2 |
Mn(OH)2 |
| 开始沉淀的pH |
3.3 |
1.5 |
6.5 |
8.0 |
8.3 |
| 沉淀完全的pH |
5.2 |
3.7 |
9.7 |
8.8 |
9.8 |
请问答下列问题:
(1)为了提高锰矿中锰元素的浸取率,可采取的措施为 。
(2)写出焙烧过程反应的化学方程式 。
(3)MnO2粗品中含有少量Mn3O4,可以用稀硫酸处理,将其转化为MnSO4和MnO2,然后再用氧化剂将Mn2+转化为MnO2,制得优质MnO2。写出Mn3O4与稀硫酸反应离子方程式:
。
(4)某兴趣小组在实验室中除去酸浸后的溶液有少量Fe2+、Fe3+.A13+、Pb2+等,得到只含的Mn2+、 SO42-的溶液,其除杂过程设计如下:

①加入MnO2氧化时发生的离子方程式为 。
②试剂X最好选用 (填字母)。
a.NaOH 溶液 b。KMnO4溶液 c。稀硝酸 d.MnCO3
③滤渣的成分是 。
(12分)双氧水、过硫酸钾是工业上常用的氧化剂、消毒剂。工业上以铂为阳极,铅或石墨为阴极,电解NH4HSO4溶液得过硫酸铵【(NH4)2S2O8】溶液,其工艺流程为:
(1)将电解后的溶液送往水解器中在减压条件下水解、蒸馏、浓缩分离,精馏得过氧化氢的水溶液,剩余溶液再循环使用。
①写出电解NH4HSO4溶液的化学方程式
②写出水解器中(NH4)2S2O8溶液的水解方程式 。
③铂价格昂贵,试分析电槽阳极用铂不用铅的原因 。
④试分析水解器中使用减压水解、蒸馏的原因 。
(2)在电解后的过硫酸铵溶液中加入硫酸氢钾,析出过硫酸钾固体,过硫酸钾具有强氧化性,常被还原为硫酸钾,80℃以上易发生分解。
①将0.40 mol过硫酸钾与0.20 mol硫酸配制成1 L溶液,在80 ℃条件下加热并在t时刻向溶液中滴加入少量FeCl3溶液,测定溶液中各成分的浓度如右图所示(H+浓度未画出)。图中物质X的化学式为 。
②已知硫酸锰(MnSO4)和过硫酸钾(K2S2O7)两种盐溶液在银离子催化下可发生反应,得到紫红色溶液。此反应的离子反应方程式 .
工业上常用铬铁矿(有效成份为FeO·Cr2O3,主要杂质为SiO2、Al2O3)为原料生产重铬酸钾(K2Cr2O7),实验室模拟工业法用铬铁矿制重铬酸钾的主要工艺流程如下图,涉及的主要反应是:6FeO·Cr2O3+24NaOH+7KClO3=12Na2CrO4+3Fe2O3+7KCl+12H2O,试回答下列问题: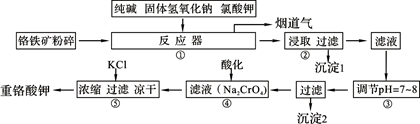
(1)⑤中溶液金属阳离子的检验方法是 。
(2)步骤③被沉淀的离子为(填离子符号) 。
(3)在反应器①中,二氧化硅与纯碱反应的化学方程式为: 。
(4)烟道气中的CO2可与H2合成甲醇。CH3OH、H2的燃烧热分别为:ΔH=-725.5 kJ/mol、ΔH=-285.8 kJ/mol,写出工业上以CO2、H2合成CH3OH的热化学方程式: 。
(5)2011年云南曲靖的铬污染事件,说明含铬废渣(废水)的随意排放对人类生存环境有极大的危害。电解法是处理铬污染的一种方法,金属铁作阳极、石墨作阴极电解含Cr2O72-的酸性废水,一段时间后产生Fe(OH)3和Cr(OH)3沉淀。
①写出电解法处理废水的总反应的离子方程式 。
②已知Cr(OH)3的Ksp=6.3×10–31,若地表水铬含量最高限值是0.1 mg/L,要使溶液中c(Cr3+)降到符合地表水限值,须调节溶液的c(OH-)≥ mol/L(只写计算表达式)。
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)工业上常用一定浓度的纯碱溶液清洗铁屑,目的是 。
(2)加入少量NaHCO3的目的是调节溶液的pH至 a,a的范围是 。
(3)已知室温下,Al(OH)3的Ksp=1.3×10-33,当pH=5时,溶液中c(Al3+)=
(4)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为 ;O2参与反应的离子方程式为
(5)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为 。
实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下: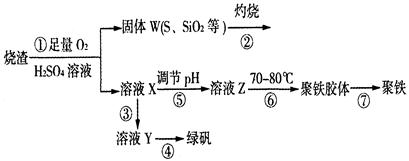
(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是 ;
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的化学方程式为: ;
(3)过程③中,需加入的物质是 ;
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有
;
(5)过程⑤调节pH可选用下列试剂中的 (填选项序号);
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70一80℃,目的是 ;
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.00g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为2.33g。若该聚铁主要成分为[(Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为 。(假设杂质中不含铁元素和硫元素)。
从化工厂铬渣中提取硫酸钠的工艺如下: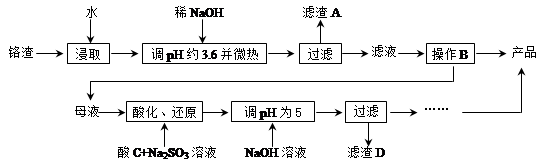
已知:①铬渣含有Na2SO4及少量Cr2O72-、Fe3+;②Fe3+、Cr3+完全沉淀(c ≤1.0×10-5 mol·L-1)时pH分别为3.6和5。
(1)“微热”除能加快反应速率外,同时还可以 ,滤渣A为 (填化学式)。
(2)根据溶解度(S)∽温度(T)曲线,操作B的最佳方法为 (填字母序号)
A.蒸发浓缩,趁热过滤
B.蒸发浓缩,降温结晶,过滤
(3)酸化后Cr2O72-可被SO32-还原成Cr3+,离子方程式为: ;酸C为 ,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]= 。
(4)根据2CrO42-+2H+  Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。
Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。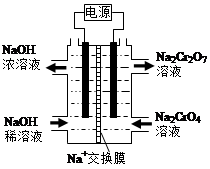
云南省曲靖的铬渣污染经媒体报道后,铬污染再次引起人们的关注。利用化学原理可以对工厂排放的含铬废水、铬渣等进行有效处理。
I.含铬废水的处理:某企业排放的含铬废水中含有较多毒性较大的Cr2O72-,某研究性学习小组为了变废为宝,将废水处理得到金属铬,设计了如下的工艺流程。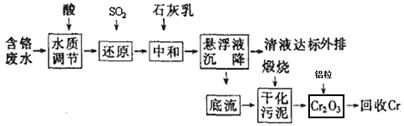
(1)加酸调节到pH=6,则用pH试纸测定溶液pH的操作是: 。
。
(2)在含Cr2O72-废水中存在着平衡:Cr2O72-+H2O 2CrO42-+2H+,请写出该平衡的平衡常数表达式k= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
2CrO42-+2H+,请写出该平衡的平衡常数表达式k= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
(3)请写出通入SO2时发生的离子反应: 。
(4)写出加入铝粒时发生反应的化学方程式 ,该反应是焓 (填“增加”或“减少”)反应。
II.铬渣的处理
铬渣烧结炼铁法:铬渣中约含有55%的氧化钙和氧化镁,此外还含有15%左右的氧化铁,这些都是炼铁所需的成份。少量的铬渣代替消石灰同铁矿粉、煤粉混合,经烧结后送入高炉冶炼,六价铬还原为三价铬或金属铬,金属铬熔入铁水,而其它成分熔入熔渣。炼铁可使铬渣彻底解毒并充分利用,是铬渣治理的良好方法之一。
碱性溶液还原法:直接在碱性铬渣中加入硫化钠等进行六价铬的还原反应,形成Cr(OH)3沉淀后,过滤回收铬污泥。
(5)铬渣烧结炼铁法中煤粉的作用是 。(写两点)
(6)请配平碱性溶液还原法中发生的离子反应:□Cr2O72-+□S2—+□H2O=□Cr(OH)3+□S2O32—+□OH—
[化拳——化学与技术](15分)
粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物组成为 等。 一种利用粉煤灰制取氧化铝的工艺流程如下:
等。 一种利用粉煤灰制取氧化铝的工艺流程如下: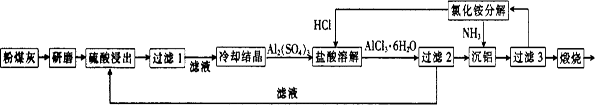
(1)粉煤灰研磨的目的是 。
(2)第1次过滤时滤渣的主要成分有 (填化学式,下同)和 ,第3次过滤时滤渣的成分是
(3)在104℃用硫酸浸取时,铝的浸取率与时间的关系如图1,适宜的浸取时间为 h;铝的浸取率与 的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在
的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在 相同时,浸取率最高的是 (填化学式);用含氟的化合物作这种助溶剂的缺点是 (举一例)。
相同时,浸取率最高的是 (填化学式);用含氟的化合物作这种助溶剂的缺点是 (举一例)。

(4)流程中循环使用的物质有——和——。(填化学式)
(5)用盐酸溶解硫酸铝晶体,再通入HCl气体,析出A1C13·6H20,该过程能够发生的原因是
(6)用粉煤灰制取含铝化合物的主要意义是
以铝灰(主要成分为Al、Al2O3,另有少量CuO、SiO2、FeO和Fe2O3杂质)为原料,可制得液体聚合氯化铝Alm(OH)nCl3m-n,生产的部分过程如下图所示(部分产物和操作已略去)。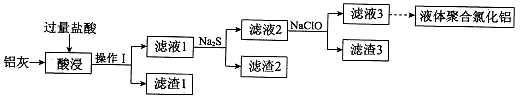
已知某些硫化物的性质如下表:
(1)操作I是 。Al2O3与盐酸反应的离子方程式是 。
(2)滤渣2为黑色,该黑色物质的化学式是 。
(3)向滤液2中加入NaClO溶液至不再产生红褐色沉淀,此时溶液的pH约为3.7。NaClO的作用是 。
(4)将滤液3的pH调至4.2~4.5,利用水解反应得到液体聚合氯化铝。反应的化学方程式是 。
(5)将滤液3电解也可以得到液体聚合氯化铝。装置如图所示(阴离子交换膜只允许阴离子通过,电极为惰性电极)。
①写出阴极室的电极反应: 。
②简述在反应室中生成聚合氯他铝的原理: 。
多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子),制备BaCl2.2H2O,工艺流程如下: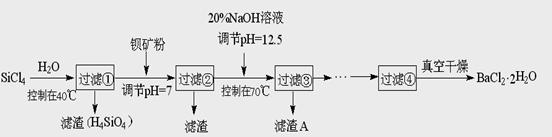
已知:
①常温下Fe3+、Mg2+完全沉淀的PH分别是3.4、12.4
②BaCO3的相对分子质量是197;BaCl2.2H2O的相对分子质量是244
回答下列问题:
⑴SiCl4发生水解反应的化学方程式_______________________________________
⑵SiCl4用H2还原可制取纯度很高的硅,当反应中有1mol电子转移时吸收59KJ热量,则该反应的热化学方程式为_____________________________________________
⑶加钡矿粉调节PH=7的作用是①使BaCO3转化为BaCl2 ②_______________________
⑷生成滤渣A的离子方程式__________________________________________
⑸BaCl2滤液经______、________、过滤、_________,再经真空干燥后得到BaCl2.2H2O
⑹10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2.2H2O___________吨。
硅藻土是由硅藻死亡后的遗骸沉积形成的,主要成分是 SiO2和有机质,并含有少量的Al2O3、Fe2O3、MgO 等杂质。精制硅藻土因为吸附性强、化学性质稳定等特点被广泛应用。下图是生产精制硅藻土并获得Al(OH)3的工艺流程。

(1)粗硅藻土高温煅烧的目的是 。
(2)反应Ⅱ中加入过量氢氧化钠的作用是 。
(3)反应Ⅲ中生成Al(OH)3沉淀的离子方程式是 ;氢氧化铝常用作阻燃剂,其原因是 。
(3)实验室用酸碱滴定法测定硅藻土中硅含量的步骤如下:
步骤1:准确称取样品a g,加入适量KOH固体,在高温下充分灼烧,冷却,加水溶解。
步骤2:将所得溶液完全转移至塑料烧杯中,加入硝酸至强酸性,得硅酸浊液。
步骤3:向硅酸浊液中加入NH4F溶液、饱和KCl溶液,得K2SiF6沉淀,用塑料漏斗过滤并洗涤。
步骤4:将K2SiF6转移至另一烧杯中,加入一定量蒸馏水,采用70 ℃水浴加热使其充分水解(K2SiF6+3H2O=H2SiO3+4HF+2KF)。
步骤5:向上述水解液中加入数滴酚酞,趁热用浓度为c mol·L-1 NaOH的标准溶液滴定至终点,消耗NaOH标准溶液VmL。
①步骤1中如何判断固体反应完成?请设计实验说明 。
②实验中使用塑料烧杯和塑料漏斗的原因是 。
③步骤3中采用饱和KCl溶液洗涤沉淀,其目的是 。
④样品中SiO2的质量分数可用公式“ ×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。
×100%”进行计算。由此分析步骤5中滴定反应的离子方程式为 。
(8分)亚氯酸钠(NaClO2)是一种重要的消毒剂。已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O,②ClO2的沸点为283K,纯ClO2易分解爆炸,③HClO2在25℃时的电离程度与硫酸的第二步电离程度相当,可视为强酸。如图是过氧化氢法生产亚氯酸钠的工艺流程图:
(1)C1O2发生器中所发生反应的离子方程式为 ,发生器中鼓入空气的作用可能是 (选填序号)。
A.将SO2氧化成SO3增强酸性
B.稀释C1O2以防止爆炸
C.将NaClO3氧化成C1O2
(2)在该实验中用质量浓度来表示NaOH溶液的组成,若实验时需要450mLl60g/L的NaOH溶液,则在精确配制时,需要称取NaOH的质量是 g,所使用的仪器除托盘天平、量筒、烧杯、玻璃棒外,还必须有
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量所需要的试剂是
(4)在吸收塔中,可代替H2O2的试剂是 (填序号)。
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
(5)从滤液中得到NaClO2·3H2O晶体的实验操作依次是 (填操作名称)
镍是有机合成的重要催化剂,某化工厂有含镍催化剂废品(主要成分是镍、杂质是铁、铝单质及其化合物,还有少量难溶性杂质)。某学习小组设计如下流程利用含镍催化剂废品制备硫酸镍晶体:

几种难溶碱开始沉淀和完全沉淀的pH:
| 沉淀物 |
开始沉淀 |
完全沉淀 |
| Al(OH)3 |
3.8 |
5.2 |
| Fe(OH)3 |
2.7 |
3.2 |
| Fe(OH)2 |
7.6 |
9.7 |
| Ni(OH)2 |
7.1 |
9.2 |
回答下列问题:
(1)溶液①中含金属元素的离子是_________________。
(2)用离子方程式表示加入双氧水的目的___________;双氧水可以用下列物质替代的是_______。
A.氧气 B.漂白液 C.氯气 D.硝酸
(3)操作a和c需要共同的玻璃仪器是_____________;操作C的名称是______________。
(4)如果加入双氧水量不足或“保温时间较短”,则所制备的产品可能含有的杂质为_____________;请选择合适的试剂,设计实验证明产品中是否含“杂质” ______________。
(5)含镍金属氢化物MH-Ni燃料电池是一种绝色环保电池,广泛应用于电动汽车。其中M代表储氢合金,MH代表金属氢化物,电解质溶液可以是KOH水溶液.它的充、放电反应为:xNi(OH)2+M  MHx+xNiOOH;电池充电过程中阳极的电极反应式为_____________,放电时负极的电极反应式为___________。
MHx+xNiOOH;电池充电过程中阳极的电极反应式为_____________,放电时负极的电极反应式为___________。
CaCl2常用于冬季道路除雪,建筑工业的防冻等,实验室常用作干燥剂。工业上常用大理石(含有少量Al3+、Fe2+、Fe3+等杂质)来制备。下图为实验室模拟其工艺流程:

已知:常温下,溶液中的Fe3+、Al3+、Fe2+以氢氧化物形式完全沉淀的pH分别为:3.7,4,9.7。
(1)写出反应Ⅰ中主要反应的离子方程式: 。
(2)反应Ⅱ中的化学方程式: 。
(3)反应Ⅲ中必须控制加入Ca(OH)2的量,使溶液的pH约为8.0,此时沉淀a的成分为: ,若pH过大,则可能发生副反应的离子方程式: 。
(4)实验用所示装置进行反应Ⅰ时,利用制取CO2进行有关性质实验,

①若烧杯中溶液为硅酸钠,则实验现象为
②若烧杯中溶液为偏铝酸钠溶液,一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为了避免固体C减少,可采取的改进措施是 。
选考【化学---选修2:化学与技术】
MgSO4·7H2O在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣-一硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等)。
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Mg(OH)2 |
| pH值 |
5.2 |
3.2 |
9.7 |
10.4 |
11.2 |
表2 两种盐的溶解度(单位为g/100g水)
| 温度/ ℃ |
10 |
30 |
40 |
50 |
60 |
| CaSO4 |
0.19 |
0.21 |
0.21 |
0.20 |
0.19 |
| MgSO4·7H2O |
30.9 |
35.5 |
40.8 |
45.6 |
/ |
硼镁泥制取七水硫酸镁的工艺流程如下:
根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)沉淀C的化学式是
(2)过滤Ⅲ需趁热过滤的理由是
(3)操作Ⅰ和操作Ⅱ的名称分别为 、
(4)滤液I中加入硼镁泥,调节溶液的pH=5~6,可除去滤液Ⅰ中 (填离子符号);加入NaClO溶液加热煮沸,可将Fe2+氧化成Fe3+的同时,还会将溶液中的Mn2+氧化成MnO2,写出Mn2+被氧化成MnO2的离子反应方程式为
(5)硼镁泥是硼镁矿生产硼砂(Na2B4O7·10H2O)时的废渣。将硼镁矿(Mg2B2O5·H2O)煅烧、粉碎后加水和纯碱,在加热加压下通入CO2可得硼砂。此反应为熵减小反应,试写出反应方程式