亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图: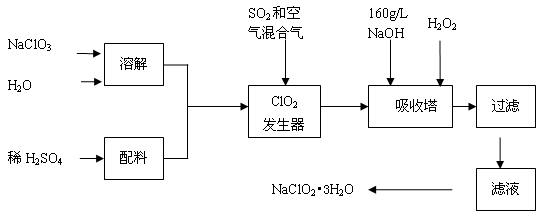
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2•3H2O。②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。回答下列问题:
(1)发生器中发生反应的离子方程式为 ,发生器中鼓入空气的作用可能是 (选填序号)。
a.将SO2氧化成SO3,增强酸性 b.稀释ClO2以防止爆炸 c.将NaClO3还原为ClO2
(2)吸收塔内反应的化学方程式为 ,吸收塔的温度不能超过20℃,其目的是 。
(3)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。以下还可以选择的还原剂是 (选填序号)。
a. Na2O2 b. Na2S c.FeCl2
(4)从滤液中得到NaClO2•3H2O粗晶体的实验操作依次是 (选填序号)。
a.蒸馏 b.蒸发 c.灼烧 d.过滤 e.冷却结晶
I 实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤: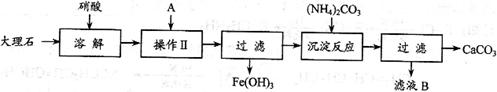
(1)用硝酸溶解大理石时通常控制反应温度不超过70℃,且不使用浓硝酸,原因是
、 。
(2)操作Ⅱ的目的是  , 若A为溶液,则A可以是 。
, 若A为溶液,则A可以是 。
(3)写出加入碳酸铵所发生反应的离子方程式:  。
。
II 以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下: 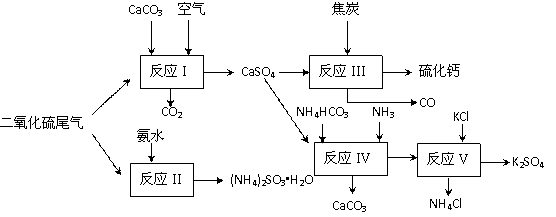
(4)已知对苯二酚是一种强还原剂。生产中,反应Ⅱ中往往需要向溶液中加入适量的对苯二酚等物质,其目的是 。
(5)下列有关说法正确的是 。
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4C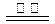 CaS +4CO↑ CaS +4CO↑ |
| C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应Ⅴ中的副产物氯化铵可用作氮肥 |
(6)反应Ⅴ反应液用40%乙二醇溶液,温度控制在25℃,硫酸钾的产率超过90%,其原因是 。
(7) (NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,试写出二氧化氮与亚硫酸铵反应的化学方程式 。
有机黏合剂是生产和生活中一类重要的材料。黏合过程一般是液态的小分子黏合剂经化学反应转化为大分子或高分子而固化。
(1)“502胶”是一种快干胶,其主要成分是α氰基丙烯酸乙酯,其结构简式为: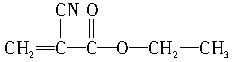
在空气中微量水催化作用下发生加聚反应,迅速固化而将被粘物粘牢。请写出“502胶”发生黏合过程的化学方程式:________________________________________________________。
(2)厌氧胶也是一种黏合剂,其结构简式为:
它在空气中稳定,但在隔绝空气(缺氧)时,分子中双键断开发生聚合而固化。工业上用丙烯酸和某种物质在一定条件下反应可制得这种黏合剂。这一制取过程的化学方程式为:
______________________________________________________________________________。
(3)白乳胶是常用的黏合剂,其主要成分为醋酸乙烯酯(CH3COOCH==CH2),它有多种同分异构体,其中同时含有“—CHO”和“—CH==CH—”结构的同分异构体共有五种,如“CH3—CH==CH—O—CHO”和“CH2==CH—CH2—O—CHO”,请写出另外三种同分异构体的结构简式(已知含有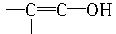 结构的物质不能稳定存在):
结构的物质不能稳定存在):
_______________________、_______________________、_______________________。
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH 与Cl2反应生成的是KClO3。写出在温度较高时KOH 与Cl2反应的化学方程式
,当反应中转移5 mol电子时,消耗的氯气是 mol。
(2)在反应液I中加入KOH固体的目的是 (填编号)。
| A.与反应液I中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高反应速率 |
| C.为下一步反应提供碱性的环境 |
| D.使KClO3转化为 KClO |
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为 。
(4)如何判断K2FeO4晶体已经洗涤干净 。
现代炼锌的方法可分为火法和湿法两大类,镉是生产硫酸锌的副产品,属于高毒性金属,试回答下列相关问题.
火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1373-1573K,使锌蒸馏出来。主要反应为: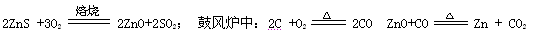
从火法炼锌蒸馏后的残渣中含多种金属单质及In2O3,可用硫酸提取铟,某研究机构对此研究数据如下。实验中涉及的酸度(每升溶液中含硫酸的质量)与铟的浸出率如下图1;硫酸溶液的体积与固体的体积比如图2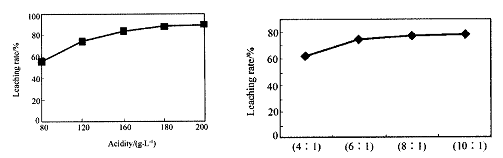
图1酸度对铟浸出率的影响 图2液固比对铟浸出率的影响
①当酸度为196时,其物质的量浓度为 。
②从节约原料和浸出率考虑,适宜的酸度和液固比分别为:_______、_______。
(2)湿法炼锌的主要工艺流程为:
①从保护环境和充分利用原料角度,如何处理或利用烟气 。
②除去酸浸出液中的铁,可用H2O2氧化,再调节pH使之形成Fe(OH)3沉淀,写出H2O2氧化Fe2+的离子方程式
③酸浸出液还含有Cd2+,为了防止镉污染并回收镉,根据它们性质的差异,可用氢氧化钠溶液分离,已知Zn(OH)2和氢氧化铝一样也具有两性,试写出分离的离子方程式____________________、_______________。
大理石中含有的主要杂质是氧化铁,以下是某化学兴趣小组用大理石为原料制取安全无毒杀菌剂过氧化钙的主要流程: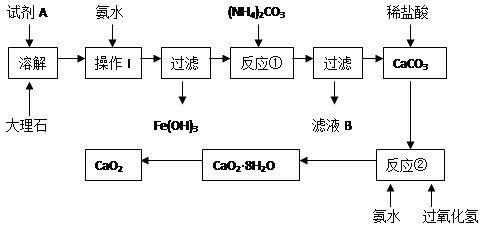
请回答下列问题:
(1)试剂A的名称是 ;
(2)操作I的目的是 ;
(3)本实验需要多次使用玻璃棒,则本实验过程中玻璃棒的作用有 ;
(4)写出反应②中生成CaO2·8H2O的化学方程式: ;
2008年10月14日长江商报报道:湖北监利钒污染致近千人患严重皮肤病。监利县有投产和在建的非法钒冶炼厂达9家,非法钒冶炼厂所造成的污染使得草木枯萎,饮水变咸,清河变浊,人畜奇怪病变,曾经的鱼米之乡正受到前所未有的污染威胁。钒和钒(V)的化合物在工业上有重要用途。如五氧化二钒是工业接触法制硫酸的催化剂。查阅资料知,利用钒矿石制五氧化二钒和钒的工艺流程图如下:
(1)钒(V)的原子序数为23,下列对钒在元素周期表中位置和元素类别判断正确的是 。
A.它位于第五周期第ⅤB族 B.它位于第四周期第ⅤB族 C.它是过渡元素
D.它位于第五周期第ⅤA族 E.它位于第四周期第ⅤA族 F.它与铁位于同一周期
(2)工业上,接触法制硫酸在接触室里发生反应:2SO2+O2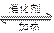 2SO3,催化剂一般是V2O5,下列对五氧化二钒作用的描述正确的是 。
2SO3,催化剂一般是V2O5,下列对五氧化二钒作用的描述正确的是 。
A.能增大该反应所需要的能量 B.能提高二氧化硫的转化率
C.能改变该反应的反应热(△H) D.能同程度增大正、逆反应速率
E.能增加SO2和O2分子的能量
(3)写出下列化学方程式:
反应I: ;反应III: ;反应IV: 。
(4)预测反应II发生的原因是 ;IV的反应类型是 。
我国化学侯德榜(右图)改革国外的纯碱生产工艺,生产流程可简要表示如下:

沉淀池中四种盐在不同温度下的溶解度(g / 100 g水)表
 |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
| NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
39.8 |
| NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
-① |
- |
- |
- |
| NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
- |
| NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.3 |
77.3 |
①>35℃NH4HCO3会有分解
请回答:
(1)沉淀池中反应温度控制在30℃~35℃,是因为若高于35℃,则 ,若低于30℃,则 ;为控制此温度范围,采取的加热方法为 。
(2) 沉淀池中发生的化学反应方程式是 。
(3)副产品的一种用途为 ,写出上述流程中X物质的分子式 。
(4)加料完毕后,继续保温30分钟,目的是 。静置后只析出NaHCO3晶体的原因是 。用蒸馏水洗涤NaHCO3晶体的目的是除去 杂质(以化学式表示)。
(5) 为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加 。
高铁酸钾是一种高效的多功能的水处理剂。工业上常采用NaClO氧化法生产,原理为:3NaClO + 2Fe(NO3)3 + 10NaOH=2Na2FeO4↓+ 3NaCl + 6NaNO3 + 5H2O
Na2FeO4+2KOH=K2FeO4+2NaOH主要的生产流程如下: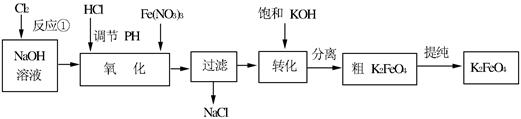
(1)写出反应①的离子方程式 。
(2)流程图中“转化”是在某低温下进行的,说明此温度下Ksp(K2FeO4) Ksp(Na2FeO4)(填“>”或“<”或“=”)。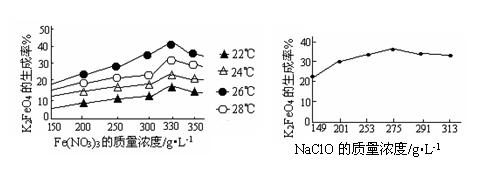
(3)反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。
上左图为不同的温度下,Fe(NO3)3不同质量浓度对K2FeO4生成率的影响;
右图为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。
①工业生产中最佳温度为 ℃,此时Fe(NO3)3与NaClO两种溶液最佳质量浓度之比为 。
②若NaClO加入过量,氧化过程中会生成Fe(OH)3,写出该反应的离子方程式:
。
若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式: 。
(4)K2FeO4在水溶液中易水解:4FeO42—+10H2O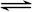 4Fe(OH)3+8OH—+3O2↑。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液(填序号)。
4Fe(OH)3+8OH—+3O2↑。在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 溶液(填序号)。
| A.H2O | B.CH3COONa、异丙醇 | C.NH4Cl、异丙醇 | D.Fe(NO3)3、异丙醇 |
硫铁矿烧渣(主要成分为Fe2O3、Fe3O4、FeO、SiO2等)是生产硫酸的工业废渣,其综合利用对环境保护具有现实意义。利用硫铁矿烧渣制备铁红等产品的实验流程如下: 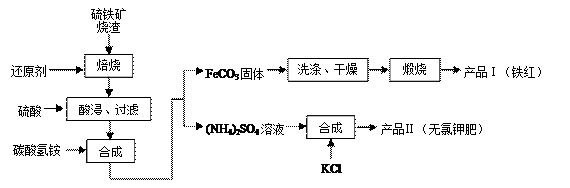
已知几种盐的溶解度随温度变化的曲线如右图所示: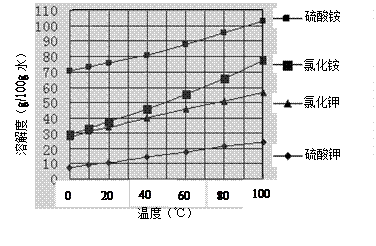
回答下列问题:
(1)酸浸、过滤后滤液中的金属阳离子是________________。
(2)煅烧FeCO3生成产品I的化学反应方程式为________________________________。
实验室进行煅烧操作所需仪器除了酒精喷灯、泥三角、三脚架、玻璃棒外,还有__________。
(3)产品Ⅱ的化学式为_______________,为了获得产品Ⅱ,向(NH4)2SO4溶液中加入KCl溶液后,还需要进行的操作是: 。
(4)检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液,
医用氯化钙 可用于补钙抗过敏等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙(CaCl2 ·2H2O的质量分数为97.3—103.0%),工艺流程为:
可用于补钙抗过敏等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医用二水合氯化钙(CaCl2 ·2H2O的质量分数为97.3—103.0%),工艺流程为: 
(1)CaCO3与盐酸反应的离子方程式 。
(2)过滤时需用的玻璃仪器除烧杯、玻璃棒外还有 。滤渣主要成分的化学式 。
(3)酸化时加盐酸的目的为:
① ,
②防止Ca2+ 在蒸发时发生水解。
(4)为什么蒸发 结晶要保持在160℃: 。
结晶要保持在160℃: 。
(5)为测定样品中CaCl2 ·2H2O的含量,称取0.7522g样品并配成250mL溶液,分别取该溶液25.00mL于三个锥形瓶中,用0.04mol/LAgNO3溶液进行三次滴定,消耗 AgNO3溶液的平均体积为20.39mL。
①通过计算,样品中含CaCl2 ·2H2O的质量分数 。
②若所测样品 CaCl2 ·2H2O的质量分数偏高(忽略其它实验误差),可能的原因之一为 。
。
(16分)纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
(1)制备纳米TiO2的方法之一是TiCl4水解生成TiO2·x H2O,该水解反应的化学方程式为 。再经过滤、水洗除去其中的Cl–,再烘干、焙烧除去水分得到粉体TiO2。检验TiO2·xH2O中Cl–是否被除净的方法是 。
(2)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
请回答下列问题:
①配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是 ;
②滴定终点的现象是 。
③滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为 。
④下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果 。
若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果 。
(本题共16分)磷矿石的主要成分是Ca5F(PO4)3,含少量MgO、Fe2O3等杂质。工业上以磷矿石为原料制备H3PO4的常用流程如下:
已知:Ca5F(PO4)3+ 7H3PO4→5Ca (H2PO4)2+HF
(1)采用这种方法在实验室溶解磷矿石________(填“能”或“不能”)用玻璃仪器,原因是_____________________________________。
(2)操作Ⅰ的名称是___________
(3)在实验室中实现操作Ⅱ和Ⅲ所需要的玻璃仪器有_______________________,推测该萃取剂一定具有的性质是_________。
a. 该萃取剂与水互不相溶 b. 相同条件下,该萃取剂的密度比水小
c. 磷酸在该萃取剂中的溶解度很小 d. 某些磷酸二氢盐在该萃取剂中的溶解度很小
(4)采用该流程除制取磷酸外,还有__________________等副产品产生,请说出其中一种副产品的用途____________________________________。
(5)与直接用硫酸溶解磷矿石的工艺相比,该工艺的优点是____________________。
苯酚和丙酮都是重要的化工原料,工业上可用异丙苯氧化法生产苯酚和丙酮,其反应和工艺流程示意图如下:
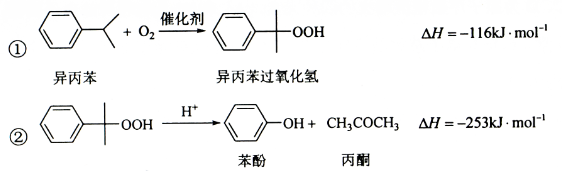

相关化合物的物理常数
| 物质 |
相对分子质量 |
密度(g/cm-3) |
沸点/℃ |
| 异丙苯 |
120 |
0.8640 |
153 |
| 丙酮 |
58 |
0.7898 |
56.5 |
| 苯酚 |
94 |
1.0722 |
182 |
回答下列问题:
(1)在反应器A中通入的X是 。
(2)反应①和②分别在装置 和 中进行(填装置符号)。
(3)在分解釜C中加入的Y为少置浓硫酸,其作用是______,优点是用量少,缺点是_____。
(4)反应②为(填“放热”或“吸热”)反应。反应温度控制在50-60℃,温度过高的安全隐患 是 。
(5)中和釜D中加入的Z最适宜的是 (填编号。已知苯酚是一种弱酸)
A. NaOH B. CaCO C. NaHCO D. CaO
(6)蒸馏塔F中的馏出物T和P分别为 和 ,判断的依据是 。
(7)用该方法合成苯酚和丙酮的优点是 。
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:

(1)MgCO3与稀硫酸反应的离子方程式为 。
(2)加入H2O2氧化时,发生反应的化学方程式为 。
(3)滤渣2的成分是 (填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C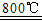 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C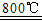 MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C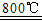 MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集。

①D中收集的气体可以是 (填化学式)。
②B中盛放的溶液可以是 (填字母)。
a、NaOH溶液 b、Na2CO3溶液 c、稀硝酸 d、KMnO4溶液
③ A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式: 。